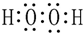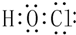题目内容
18.下表列出了①~⑨九种元素在周期表中的位置.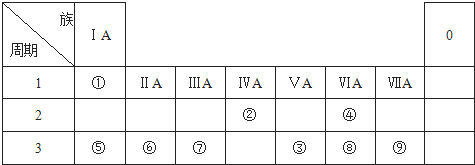
请按要求回答下列问题:
(1)由①②④三种元素组成的一种有机物的结构简式CH3OH;①、④按原子个数比为1:1组成的分子的电子式
 ;元素⑦的原子结构示意图
;元素⑦的原子结构示意图 .
.(2)⑤⑥两种元素的原子半径由大到小的顺序是Na>Mg(填元素符号).
(3)⑧和⑨两种元素的最高价氧化物对应的水化物中酸性较弱的是H2SO4(填化学式).
(4)元素③的气态氢化物和元素⑧的气态氢化物易于制备的是H2S(填化学式).
(5)元素⑤的最高价氧化物对应的水化物与元素⑦的最高价氧化物对应水化物反应,其离子方程式为Al(OH)3+OH-=AlO2-+2H2O
(6)元素①、④、⑤之间可以形成两种类型的化合物,写出一种共价化合物的化学式H2O;一种离子化合物的化学式Na2O.
分析 根据元素在周期表中的位置知,①②③④⑤⑥⑦⑧⑨分别是H、C、P、O、Na、Mg、Al、S、Cl元素,
(1)最简单的有机含氧衍生物为甲醇,满足此条件的还有很多,如醛、酮、醚酯、羧酸等;双氧水中两个氢原子分别与两个氧原子通过共用一对电子结合,两个氧原子之间通过共用1对电子结合;Al原子序数为13,有3个电子层,最外层3个电子;
(2)同一周期,原子序数越大,半径越小;
(3)元素的非金属性越强,其对应最高价氧化物的水化物的酸性越强;
(4)元素的非金属性越强,其气态氢化物越容易制备;
(5)氢氧化铝具有两性,能与强碱反应生成偏铝酸盐;
(6)非金属与非金属间容易形成共价键,活泼金属与非金属容易形成离子键.
解答 解:根据元素在周期表中的位置知,①②③④⑤⑥⑦⑧⑨分别是H、C、P、O、Na、Mg、Al、S、Cl元素,
(1)由H、C和O三种元素组成的有机化合物很多,所有含O烃的衍生物均可,最简单的一种有机物为甲醇CH3OH,双氧水为共价化合物,分子中存在两个氧氢键和一个O-O键,双氧水的电子式为: ,Al原子序数为13的元素,质子数为13,核外电子数为13,有3个电子层,最外层有3个电子,原子结构示意图为
,Al原子序数为13的元素,质子数为13,核外电子数为13,有3个电子层,最外层有3个电子,原子结构示意图为 ,故答案为:CH3OH;
,故答案为:CH3OH; ;
; ;
;
(2)Na与Mg均属于同种周期元素,由原子序数Mg>Na,故半径Na>Mg,故答案为:Na>Mg;
(3)由于非金属性Cl>S,故酸性:高氯酸大于硫酸,故答案为:H2SO4;
(4)由于非金属性S>P,故H2S更易制备,故答案为:H2S;
(5)氢氧化铝与氢氧化钠反应生成偏铝酸钠和水,氢氧化铝难溶,不能拆,水为氧化物不能拆,离子反应方程式为:Al(OH)3+OH-=AlO2-+2H2O,故答案为:Al(OH)3+OH-=AlO2-+2H2O;
(6)H、O和Na形成的共价化合物为水,离子化合物为过氧化钠、氧化钠、氢氧化钠等,故答案为:H2O; Na2O.
点评 本题考查了元素周期表和元素周期律的综合应用,明确物质的性质是解本题关键,结合元素周期律来分析解答.

①CH3Cl②CH2Cl2③CHCl3④CCl4⑤HCl.
| A. | 只有①⑤ | B. | ①②③④的混合物 | C. | 只有②⑤ | D. | ①②③④⑤的混合物 |
| A. | Cu | B. | K2SO4 | C. | SO2 | D. | NaOH溶液 |
| A. | NaCl | B. | NaHSO4 | C. | NaHCO3 | D. | CH3COOH |
| A. | 实验室中可用燃烧法处理CO、H2、H2S等可燃性尾气 | |
| B. | 检验硫酸亚铁铵晶体中是否含有结晶水:取一试管,用药匙加入2克硫酸亚铁铵晶体,并在试管口塞上一团蘸有少量无水硫酸铜粉末的棉花,同时塞紧塞子,点燃酒精灯加热试管,观察现象 | |
| C. | 取一药匙铁粉、半药匙食盐置于一片塑料薄膜上,混合均匀,滴一滴管水,包起塑料薄膜(不包紧,有空气),用手摸立刻有发烫感 | |
| D. | 在中和滴定实验中,既可用标准溶液滴定待测液,也可用待测液滴定标准溶液 |
| A. | 混合气体的密度不再改变的状态 | |
| B. | 单位时间生成2n mol C,同时生成n mol D | |
| C. | 混合气体的压强不再改变的状态 | |
| D. | A、B、C、D的分子数之比为1:3:2:1 |
| A. | 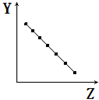 表示第三周期元素的原子半径(稀有气体除外) | |
| B. | 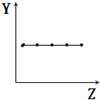 表示ⅡA族元素的最外层电子数 | |
| C. | 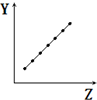 表示第二周期元素的电负性(稀有气体除外) | |
| D. | 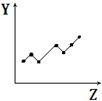 表示第三周期元素的第一电离能(稀有气体除外) | |
| E. | 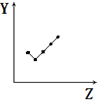 表示第ⅦA族元素氢化物的沸点. |
| 时间/min | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c3 |
| 4 | c1 | c2 | c3 | c3 |
A.容器内压强不变
B.CO的消耗速率等于CO2的生成速率
C.混合气体中CO的体积分数不变
D.c(CO2):c(H2)=1:l
(2)上表中:cl=0.08mol/L.