题目内容
2. 某温度下,Fe(OH)3(s)、Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度的变化如图所示.据图分析,下列判断正确的是( )
某温度下,Fe(OH)3(s)、Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度的变化如图所示.据图分析,下列判断正确的是( )| A. | Ksp[Fe(OH)3]<Ksp[Cu(OH)2] | |
| B. | 加适量NH4Cl固体可使溶液由a点变到b点 | |
| C. | 对a、b两点的Ksp前者大于后者 | |
| D. | Fe(OH)3、Cu(OH)2分别在b、c两点代表的溶液中达到饱和 |
分析 A、由b、c两点对应数据可比较出KSP[Fe(OH)3]与KSP[Cu(OH)2]的大小;
B、向溶液中加入NH4Cl固体,会导致溶液中的c(OH-)减小;
C、Ksp只与温度有关;
D、b、c两点分别处在两条的沉淀溶解平衡曲线上,故两点均代表溶液达到饱和.
解答 解:A、由b、c两点对应数据可比较出KSP[Fe(OH)3]与KSP[Cu(OH)2]的大小,KSP[Fe(OH)3]=c(Fe3+)•(OH-)3=c(Fe3+)•(10-12.7)3,KSP[Cu(OH)2]=c(Cu2+)•(OH-)2=c(Cu2+)•(10-9.6)2,因c(Fe3+)=c(Cu2+),故KSP[Fe(OH)3]<KSP[Cu(OH)2],故A正确;
B、向溶液中加入NH4Cl固体,铵根离子与氢氧根离子结合生成一水合氨,会导致溶液中的c(OH-)减小,故不能使溶液由a点变到b点,故B错误;
C、只要温度不发生改变,Ksp就不变,该题中温度条件不变,所以a、b两点的Ksp相等,故C错误;
D、曲线为沉淀溶解平衡曲线,曲线上的点为平衡点,已知b、c两点分别处在两条的沉淀溶解平衡曲线上,所以两点均代表溶液达到饱和,故D正确.
故选AD.
点评 本题考查了沉淀溶解平衡、溶度积、pH、水的离子积等,对图象中的数据进行定量或定性处理,找出数据(或坐标点)之间存在的相互关系;明确坐标点所表达的涵义;对溶度积和水的离子积有正确的理解,题目难度中等.

练习册系列答案
 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案
相关题目
19.下列离子方程式书写正确的是( )
| A. | 澄清石灰水与盐酸混合Ca(OH)2+2H+=Ca2++2H2O | |
| B. | 氢氧化铁与盐酸反应H++OH-=H2O | |
| C. | 氯化钡溶液与稀硫酸混合Ba2++SO42-=BaSO4↓ | |
| D. | 铝与硝酸汞溶液反应Al+Hg2+=Al3++Hg |
13.常温下,将下列物质溶于水中分别配制成0.1mol•L-1溶液,所得溶液pH大于7的是( )
| A. | NaCl | B. | NaHSO4 | C. | NaHCO3 | D. | CH3COOH |
10.在恒容密闭容器中,一定温度下,可逆反应A(s)+3B(g)?2C(g)+D(g)达到平衡状态的标志是( )
| A. | 混合气体的密度不再改变的状态 | |
| B. | 单位时间生成2n mol C,同时生成n mol D | |
| C. | 混合气体的压强不再改变的状态 | |
| D. | A、B、C、D的分子数之比为1:3:2:1 |
17.将0.1mol N2和0.3mol H2置于密闭容器中发生反应:N2+3H2$?_{催化剂}^{高温、高压}$2NH3,下列关于该反应的说法中正确的是( )
| A. | 增大压强,反应速率减小 | |
| B. | 最终可生成0.2 mol NH3 | |
| C. | 升髙温度,反应速率增大 | |
| D. | 当V正(N2):V 正(H2)=1:3时,一定达化学平衡状态 |
7.下列曲线分别表示元素的某种性质与核电荷数的关系(Z为核电荷数,Y为元素的有关性质).则下列有关Y的意义的叙述正确的是 ( )
| A. | 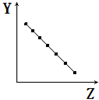 表示第三周期元素的原子半径(稀有气体除外) | |
| B. | 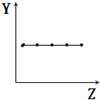 表示ⅡA族元素的最外层电子数 | |
| C. | 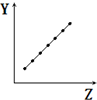 表示第二周期元素的电负性(稀有气体除外) | |
| D. | 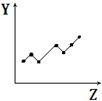 表示第三周期元素的第一电离能(稀有气体除外) | |
| E. | 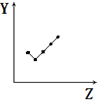 表示第ⅦA族元素氢化物的沸点. |
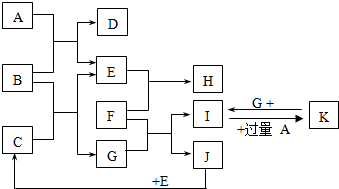 如图为一些常见物质间的相互转化关系,其中F为金属,高温下能与某些金属氧化物反应,是工业冶炼金属的方法之一. A为无色气体,B为淡黄色固体,C为无色液体,E和J为无色气体单质.
如图为一些常见物质间的相互转化关系,其中F为金属,高温下能与某些金属氧化物反应,是工业冶炼金属的方法之一. A为无色气体,B为淡黄色固体,C为无色液体,E和J为无色气体单质.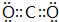 ;
; ,该烯烃的结构简式和名称为CH3CH═CHCH(CH3)CH2CH═CHCH2CH3,4-甲基-2,7-壬二烯.
,该烯烃的结构简式和名称为CH3CH═CHCH(CH3)CH2CH═CHCH2CH3,4-甲基-2,7-壬二烯.