题目内容
【题目】氯气有毒,且大量制取的难度较大、污染严重,在培养皿中研究氯气的性质可实现“绿色实验”。在培养皿的点滴板中央孔穴中滴加能生成氯气的试剂(如漂白精与盐酸),然后分别滴加所要进行实验的试剂,如图。下列是某学生观察到的现象、解释与结论,其中不符合事实的是
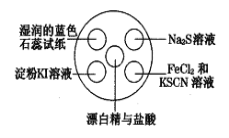
选项 | 实验现象 | 解释 | 结论 |
A | 淀粉KI溶液变蓝 | 氯气置换出KI中的碘使淀粉变蓝 | 单质氧化性:Cl2>I2 |
B | Na2S溶液中出现淡黄色沉淀 | 氯气置换出Na2S中的硫 | 单质氧化性:Cl2>S |
C | 湿润的蓝色石蕊试纸先变红后褪色 | 氯气与水反应生成盐酸和次氯酸 | 氯气具有漂白性 |
D | FeCl2和KSCN溶液的小液滴变红 | FeCl2被Cl2氧化成FeCl3后,再与KSCN溶液反应变红 | 氯气具有氧化性 |
A.AB.BC.CD.D
【答案】C
【解析】
氯气具有氧化性,氧化剂的氧化性大于氧化产物的氧化性,氯气没有漂白性。
A.氯气氧化![]() 生成碘,试纸变成蓝色,氧化剂氧化性大于氧化产物氧化性,则氧化性
生成碘,试纸变成蓝色,氧化剂氧化性大于氧化产物氧化性,则氧化性![]() 较强,单质的氧化性:
较强,单质的氧化性:![]() ,故A正确;
,故A正确;
B.氯气氧化![]() 生成S单质,溶液中出现淡黄色沉淀,氧化剂氧化性大于氧化产物氧化性,则氧化性
生成S单质,溶液中出现淡黄色沉淀,氧化剂氧化性大于氧化产物氧化性,则氧化性![]() 较强,单质氧化性:
较强,单质氧化性:![]() ,故B正确;
,故B正确;
C.氯气与水反应生成盐酸和次氯酸,使湿润的蓝色石蕊试纸先变红后褪色,说明次氯酸具有漂白性,故C错误;
D.![]() 遇到氯气被氧化成
遇到氯气被氧化成![]() ;
;![]() 与
与![]() 溶液反应变红,说明氯气具有强氧化性,故D正确;
溶液反应变红,说明氯气具有强氧化性,故D正确;
故本题选择C。

 名校课堂系列答案
名校课堂系列答案【题目】硫酸亚铁铵[(NH4)2Fe(SO4)2]是分析化学中的重要试剂,在不同温度下加热分解所得产物不同。设计如图实验装置(夹持装置略去),在500℃时隔绝空气加热A中的硫酸亚铁铵至分解完全,确定分解产物(铁的氧化物、硫的氧化物、含氮物质、水)的具体成分(已知每个装置中的药品足量)。
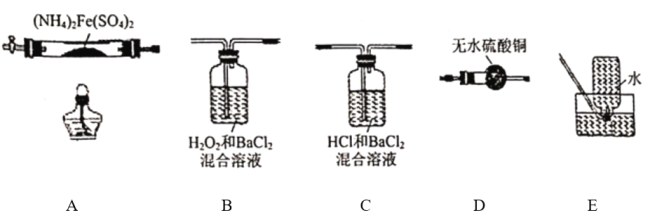
(1)利用上述装置完成该实验,则该装置的正确连接顺序为_______________(用装置下面的字母填连接顺序,每个装置都要使用)。加热A前需要通入一段时间N2目的是_______________。
(2)若观察到B中有白色沉淀生成,C中无明显现象,则装置C的作用为_______________,D中白色变为蓝色,写出B中发生反应的离子方程式_______________装置B与装置C能否互换_______________(填 “能”或“否”),原因是_______________(填“能”则不填此空)。
(3)A中固体完全分解后变为红棕色粉末,某同学设计实验验证固体残留物仅为Fe2O3,而不含FeO,请帮他完成表中内容(试剂,仪器和用品自选)。
实验步骤 | 预期现象 | 结论 |
_______________ | _______________ | 固本残留物仅为Fe2O3 |
(4)硫酸亚铁铵在500℃时隔绝空气加热完全分解,若E中收集到的气体只有N2,A中固体残留物Fe2O3的质量为80g,B中沉淀物质的量为2rnol,则生成N2的质量为_______________g。
(5)某含铬(Cr2O72-)废水用硫酸亚铁铵溶液滴定处理,反应后铁元素和铬元素完全转化为沉淀(沉淀中铬元素化合价为+3),该沉淀经干燥后得到amolFeOFemCrnO3,不考虑处理过程中的实际损耗,则消耗硫酸亚铁铵的物质的量为_______________mol(用a的代数式表示)。
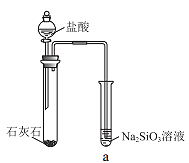
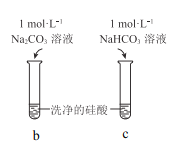
【题目】硅酸(H2SiO3)是一种难溶于水的弱酸,从溶液中析出时常形成凝胶状沉淀。实验室常用Na2SiO3溶液制备硅酸。某小组同学进行了如下实验:下列结论不正确的是( )
编号 | Ⅰ | Ⅱ |
实验 |
|
|
现象 | a 中产生凝胶状沉淀 | b 中凝胶状沉淀溶解,c 中无明显变化 |
A.Na2SiO3溶液一定显碱性
B.由Ⅰ能说明酸性H2CO3>H2SiO3
C.由Ⅱ可知,同浓度时Na2CO3溶液的碱性强于NaHCO3溶液
D.向Na2SiO3溶液中通入少量CO2,发生反应:SiO32-+CO2+H2O=CO32-+H2SiO3↓