题目内容
【题目】常温下,在新制氯水中滴加NaOH溶液,溶液中水电离出来的![]() 的负对数与NaOH溶液体积之间的关系如图所示,下列说法正确的
的负对数与NaOH溶液体积之间的关系如图所示,下列说法正确的
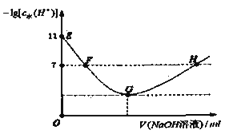
A.用pH试纸测定E点对应的溶液,![]()
B.F.H点对应的溶液都存在![]()
C.加水稀释H点对应的溶液,溶液的pH不变
D.G点对应的溶液中![]()
【答案】D
【解析】
A.E点新制氯水溶液,溶液显酸性,由水电离出的![]() ,溶液中
,溶液中![]() 完全是由水电离出来的,据此计算;
完全是由水电离出来的,据此计算;
B.G点为完全反应生成NaClO,NaClO促进水的电离,在G点之前HClO未完全反应,H点为过量NaOH溶液存在,H点溶液为碱性,F点溶液为中性;
C.加水稀释H点对应的溶液,H点为碱性溶液,加水稀释时促使溶液pH值接近中性;
D.G点为完全反应生成NaClO,溶液呈碱性,ClO-水解,据此分析。
A. E点新制氯水溶液,溶液显酸性,由水电离出的![]() ,溶液中
,溶液中![]() 完全是由水电离出来的,所以
完全是由水电离出来的,所以![]() ,则溶液中
,则溶液中![]() ,则溶液pH=3,但新制氯水溶液有漂白性,不能用pH试纸测量该溶液的pH,故A错误;
,则溶液pH=3,但新制氯水溶液有漂白性,不能用pH试纸测量该溶液的pH,故A错误;
B. H点对于溶液中溶质为NaCl、NaClO和NaOH,根据电荷守恒可知:c(Na+)+c(H+)=c(OH)+c(Cl)+c(ClO,此时溶液为碱性,则c(OH)>c(H+),所以c(Na+)>c(Cl)+c(ClO),故B错误;
C. 加水稀释H点对应的溶液,H点为碱性溶液,加水稀释时促使溶液pH值接近中性,所以pH值降低,故C错误;
D. G点为完全反应生成NaClO,溶液呈碱性,ClO水解,新制氯水中起始时是等量的HCl和HClO,所以有![]() ,故D正确,
,故D正确,
故答案选:D。

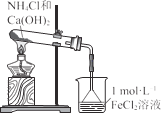
【题目】氯气有毒,且大量制取的难度较大、污染严重,在培养皿中研究氯气的性质可实现“绿色实验”。在培养皿的点滴板中央孔穴中滴加能生成氯气的试剂(如漂白精与盐酸),然后分别滴加所要进行实验的试剂,如图。下列是某学生观察到的现象、解释与结论,其中不符合事实的是
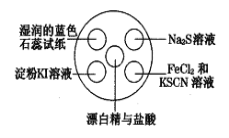
选项 | 实验现象 | 解释 | 结论 |
A | 淀粉KI溶液变蓝 | 氯气置换出KI中的碘使淀粉变蓝 | 单质氧化性:Cl2>I2 |
B | Na2S溶液中出现淡黄色沉淀 | 氯气置换出Na2S中的硫 | 单质氧化性:Cl2>S |
C | 湿润的蓝色石蕊试纸先变红后褪色 | 氯气与水反应生成盐酸和次氯酸 | 氯气具有漂白性 |
D | FeCl2和KSCN溶液的小液滴变红 | FeCl2被Cl2氧化成FeCl3后,再与KSCN溶液反应变红 | 氯气具有氧化性 |
A.AB.BC.CD.D
【题目】如图是实验室制备氯气并进行一系列相关实验的装置(夹持设备己略)
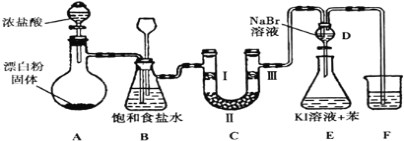
(1)装置A是氯气的发生装置,浓盐酸可与漂白粉的有效成分反应生成氯气。请写出相应反应的化学方程式:__________________________________;装置A部分用来装漂白粉的仪器名称是____________。
(2)装置B中饱和食盐水的作用是___________________________,同时装置B也是安全瓶,监测实验进行时C中是否发生堵塞。请写出C中发生堵塞时B中的现象_________ 。
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ处依次放入物质的组合应是___________(填字母编号).
编号 | Ⅰ | Ⅱ | Ⅲ |
a | 干燥的有色布条 | 碱石灰 | 湿润的有色布条 |
b | 干燥的有色布条 | 无水硫酸铜 | 湿润的有色布条 |
c | 湿润的有色布条 | 浓硫酸 | 干燥的有色布条 |
d | 湿润的有色布条 | 无水氯化钙 | 干燥的有色布条 |
(4)设计装置D、E的目的验证氧化性强弱顺序:Cl2 >Br2 >I2。反应一段时间后,打开活塞,将装置D中少量溶液加入装置E中,振荡,观察到的现象是_____________________,该现象______(填“能”或“不能”)说明溴单质的氧化性强于碘,原因是________________。
(5)装置F的作用是___________,其烧杯中的溶液不能选用下列中的____________(填字母编号)。
a.饱和NaOH溶液 b.饱和NaCl溶液
c.饱和Na2SO3溶液 d.饱和Na2CO3溶液.