题目内容
【题目】高温下铝粉与氧化铁的反应可以用来焊接钢轨,该反应会放出大量的热,使置换出的铁呈熔融态,从而达到焊接目的。下列分析错误的是
A.该反应不属于氧化还原反应
B.被还原的物质是氧化铁
C.该反应的还原剂是铝粉
D.该反应可以用来冶炼某些熔点高的金属
【答案】A
【解析】
铝热反应的发生是因为铝单质具有较强的还原性,且反应放出大量的热。该反应的化学方程式为:2Al + Fe2O3![]() Al2O3+2Fe,反应中铝元素从零价升高到正三价,铁元素从正三价降低到零价,所以铝是还原剂,氧化铁是氧化剂,据此进行判断。
Al2O3+2Fe,反应中铝元素从零价升高到正三价,铁元素从正三价降低到零价,所以铝是还原剂,氧化铁是氧化剂,据此进行判断。
A.根据反应的化学方程式:2Al + Fe2O3![]() Al2O3+2Fe,反应中铝元素化合价升高,铁元素化合价降低,属于氧化还原反应,A选项错误;
Al2O3+2Fe,反应中铝元素化合价升高,铁元素化合价降低,属于氧化还原反应,A选项错误;
B.被还原的物质是氧化剂,所含元素化合价降低,所以被还原的物质是氧化铁,B选项正确;
C.还原剂在反应中所含元素化合价升高,所以C选项正确;
D.铝单质的还原性强,且该反应放出大量的热,可以用来冶炼某些熔点高的金属,比如锰、钨等,D选项正确;
答案选A。

【题目】氯气有毒,且大量制取的难度较大、污染严重,在培养皿中研究氯气的性质可实现“绿色实验”。在培养皿的点滴板中央孔穴中滴加能生成氯气的试剂(如漂白精与盐酸),然后分别滴加所要进行实验的试剂,如图。下列是某学生观察到的现象、解释与结论,其中不符合事实的是
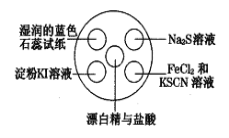
选项 | 实验现象 | 解释 | 结论 |
A | 淀粉KI溶液变蓝 | 氯气置换出KI中的碘使淀粉变蓝 | 单质氧化性:Cl2>I2 |
B | Na2S溶液中出现淡黄色沉淀 | 氯气置换出Na2S中的硫 | 单质氧化性:Cl2>S |
C | 湿润的蓝色石蕊试纸先变红后褪色 | 氯气与水反应生成盐酸和次氯酸 | 氯气具有漂白性 |
D | FeCl2和KSCN溶液的小液滴变红 | FeCl2被Cl2氧化成FeCl3后,再与KSCN溶液反应变红 | 氯气具有氧化性 |
A.AB.BC.CD.D