题目内容
【题目】为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验。请回答相关问题。
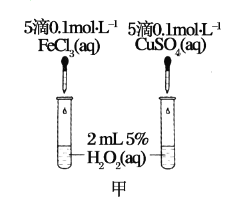
(1)定性如图甲可通过观察_______________,定性比较得出结论。有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是______________。
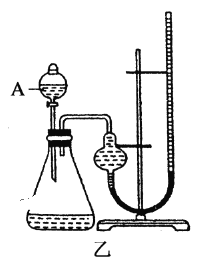
(2)定量如图乙所示,实验时均以生成20mL气体为准,其他可能影响实验的因素均已忽略。图中仪器A的名称为________,实验中需要测量的数据是________,为了减少实验误差,反应前后量气管两边液面的高度应保持一致,则在反应后应采取的操作方法是_______________。
【答案】反应产生气泡快慢(或反应完成的先后,或试管壁的冷热程度) 将阴离子改为相同,排除阴离子的干扰 分液漏斗 时间(或收集一定体积的气体所需要的时间) 慢慢将右面的量气管向下移动
【解析】
(1)根据反应生成气体的快慢分析来比较催化效果;根据H2O2分解的催化作用有可能是氯离子起的作用,改为Fe2(SO4)3使阴离子相同,更为合理;根据反应物、生成物、反应条件写出反应方程式;(2)A为分液漏斗,根据乙图装置来选择气密性的检查方法;该反应是通过反应速率分析的,所以根据v=△c/△t来判断
(1)根据反应生成气体的快慢分析来比较催化效果;在探究Fe3+和Cu2+对H2O2分解的催化效果时,必须保持其他的条件相同,所以将FeCl3改为Fe2(SO4)3更为合理,可以避免由于阴离子不同造成的干扰,
故答案为:反应产生气泡快慢(或反应完成的先后,或试管壁的冷热程度);将阴离子改为相同,排除阴离子的干扰;
(2)由图可知,A为分液漏斗;定量比较Fe3+和Cu2+对H2O2分解的催化效果,可以通过测定产生20mL的气体所需的时间来比较,产生20mL的气体所需的时间越短,则催化效果越好。反应产生气体压强增大,左管液面低,右管液面高,应使右管下移,水进入右管,左管体积增大,压强减小,左右压强相等,液面相平。
故答案为:分液漏斗;收集20mL气体所需要的时间,慢慢将右面的量气管向下移动。

 巧学巧练系列答案
巧学巧练系列答案【题目】皮革工业污泥中含较多的Cr,工业采用以下工芝制得M[Cr(OH)(H20)5S04]。
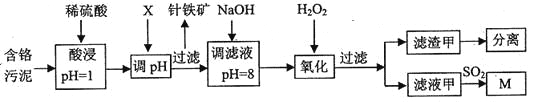
已知:①工艺中硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Cu2+、Mg2+。
②常温下部分阳离子以氢氧化物沉淀形式存在时溶液的pH见下表:
阳离子 | Fe3+ | Al3+ | Cu2+ | Mg2+ | Cr3+ |
开始沉淀时的pH | 1.9 | 3.7 | 4.7 | 6.7 | --- |
沉淀完全时的pH | 3.2 | 8.0 | 6.7 | 9.3 | 9(>9溶解) |
(1)酸浸时,为了提高浸取效率可采取的措施是________(任写一条)。
(2)调节pH所用X可以选用______。
A.NaOH B.Na2C03C.H2S04D.HN03
(3)加入H202目的,是把Cr(OH)3沉淀转化为Cr2072-。该转化过程中,消耗的H202与Cr(OH)3的物质的量之比为________。
(4)调滤液至pH=8,则滤液中______将转化为沉淀(选填Al3+、Cu2+、Mg2+)。
(5)若滤液甲的pH=a,则溶液中c(Cu2+)=______。(25°C时的Ksp[Cu(OH)2]=2.2×10-20)






