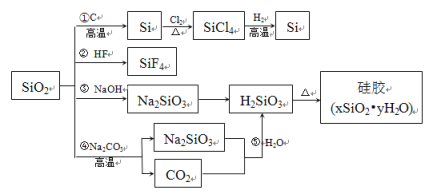
题目内容
【题目】明矾[ KAl(SO4)2·12H2O ]在造纸、净水等方面应用广泛。以处理过的废旧易拉罐碎屑为原料(主要成分为Al,含有少量的Fe、Mg杂质)制备明矾的过程如下图所示。
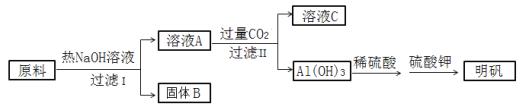
回答下列问题:
(1)KAl(SO4)2的电离方程式______________________________。
(2)原料溶解过程中反应的离子方程式是___________________________________。
(3)明矾溶液与过量的Ba(OH)2溶液反应的离子方程式是______________________________。
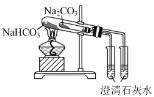
(4)溶液A中通入过量CO2,反应的化学方程式是_____________________________________。
(5)为证明固体B中含有铁,某同学做如下实验:取少量固体B,加入稀硫酸使其溶解,观察到有无色气体生成。向溶液中加入__________和__________,溶液立即变红,证明固体B中含有铁。
【答案】KAl(SO4)2=K++Al3++2SO42- 2Al+2OH-+2H2O=2AlO2-+3H2↑ Al3++2SO42-+2Ba2++4OH-=AlO2-+2BaSO4+2H2O NaAlO2+2H2O+ CO2=Al(OH)3+NaHCO3 硫氰化钾溶液 氯水或双氧水
【解析】
原料中的Al可与NaOH反应生成偏铝酸钠,则固体B为Fe、Mg杂质;偏铝酸钠与过量的二氧化碳反应生成氢氧化铝沉淀和碳酸氢钠溶液,则C为碳酸氢钠溶液。
(1) KAl(SO4)2为盐,属于强电解质,在溶液中完全电离生成钾离子、铝离子和硫酸根离子,电离方程式为KAl(SO4)2=K++Al3++2SO42-;
(2) 原料溶解过程中,Al与NaOH反应生成偏铝酸钠和氢气,离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑;
(3) 明矾溶液与过量的Ba(OH)2溶液反应生成硫酸钡沉淀、偏铝酸钾和水,反应的离子方程式为Al3++2SO42-+2Ba2++4OH-=AlO2-+2BaSO4+2H2O;
(4)A溶液为偏铝酸钠溶液,通入过量的二氧化碳生成碳酸氢钠和氢氧化铝沉淀,化学方程式为NaAlO2+2H2O+ CO2=Al(OH)3+NaHCO3;
(5)若有Fe时,溶液为硫酸亚铁,则加入KSCN溶液时,溶液无变化,再加入氯气或双氧水,氧化为三价铁离子时溶液变为血红色。