题目内容
【题目】如图为铅蓄电池的示意图。下列说法正确的是
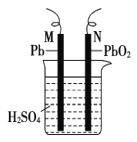
A.放电时,N 为负极,其电极反应式为 PbO2+SO42—+4H++2e-=PbSO4+2H2O
B.放电时,c(H2SO4)不变
C.充电时,阳极反应式为 PbSO4+2e-=Pb+SO42-
D.充电时,若 N 连电源正极,则该极生成 PbO2
【答案】D
【解析】
A. 铅蓄电池的总反应PbO2+2H2SO4+Pb ![]() 2PbSO4+2H2O可知,放电时,Pb被氧化,则M应为电池负极反应,电极反应式为:Pb2e+SO42=PbSO4,故A错误;
2PbSO4+2H2O可知,放电时,Pb被氧化,则M应为电池负极反应,电极反应式为:Pb2e+SO42=PbSO4,故A错误;
B. 放电时,负极反应:Pb2e+SO42=PbSO4,正极上:4H++PbO2+SO42+2e=2H2O+PbSO4,两个电极质量增加,但是反应中硫酸被消耗,浓度减小,故B错误;
C. 充电时,阳极发生失电子的氧化反应,2H2O+PbSO42e=4H++PbO2+SO42,故C错误;
D. 充电时,若N连电源正极,N为阳极,阳极上硫酸铅发生失电子的氧化反应:2H2O+PbSO42e=4H++PbO2+SO42,该极生成PbO2,故D正确。
答案选D。

 阅读快车系列答案
阅读快车系列答案【题目】部分弱酸的电离平衡常数如表:
弱酸 | HCOOH | HClO | H2CO3 | H2SO3 |
电离平衡 常数(25℃) | Ka=1.77×10-4 | Ka=4.0×10-8 | Ka1=4.3×10-7 Ka2=4.7×10-11 | Ka1=1.54×10-2 Ka2=1.02×10-7 |
(1)室温下①0.1mol·L-1HCOONa;②0.1mol·L-1NaClO;③0.1mol·L-1Na2CO3;④0.1mol·L-1NaHCO3四种溶液的pH由大到小的关系为________________。(用序号填空)
(2)浓度均为0.1 mol·L-1的Na2SO3和Na2CO3的混合溶液中,SO32-、CO32-、HSO3-、HCO3-浓度从大到小的顺序为________________。
(3)下列离子方程式正确的是___________(填字母)。
A.2ClO-+H2O+CO2=2HClO+CO32- B.2HCOOH+CO32-=2HCOO-+H2O+CO2↑
C.H2SO3+2HCOO-=2HCOOH+SO32- D.Cl2+H2O+2CO32-=2HCO3-+Cl-+ClO-
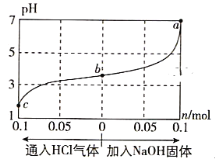
(4)某温度(T℃)下的溶液中,c(H+)=10-xmol·L-1,c(OH-=10-ymol·L-1,x与y的关系如图所示。

①此温度下,0.01mol/L的NaOH溶液中水电离出的OH-浓度为_______。
②在此温度下,0.1mol·L-1的NaHSO4溶液与0.1mol·L-1的Ba(OH)2溶液按下表中甲、乙、丙、丁不同方式混合:
甲 | 乙 | 丙 | 丁 | |
0.1mol·L-1的Ba(OH)2 | 10 | 10 | 10 | 10 |
0.1mol·L-1的NaHSO4 | 5 | 10 | 15 | 20 |
按甲方式混合后,所得溶液的pH为____________;
按乙方式混合后,其反应的离子方程式:_________________。
按丁方式混合后,所得溶液显____________(填“酸”“碱”或“中”)性
【题目】碳酸镁晶须是一种新型的吸波隐形材料中的增强材料。
(1)合成该物质的步骤如下:
步骤1:配制0.5mol·L-1 MgSO4溶液和0.5mol·L-1 NH4HCO3溶液。
步骤2:用量筒量取500mL NH4HCO3溶液于1000mL三颈烧瓶中,开启搅拌器。温度控制在50℃。
步骤3:将250mL MgSO4溶液逐滴加入NH4HCO3溶液中,1min内滴加完后,用氨水调节溶液pH到9.5。
步骤4:放置1h后,过滤,洗涤。
步骤5:在40℃的真空干燥箱中干燥10h,得碳酸镁晶须产品(MgCO3·nH2O n=1~5)。
①步骤2控制温度在50℃,较好的加热方法是_________。
②步骤3生成MgCO3·nH2O沉淀的化学方程式为__________。
③步骤4检验沉淀是否洗涤干净的方法是__________。
(2)测定生成的MgCO3·nH2O中的n值。
称量1.000碳酸镁晶须,放入如图所示的广口瓶中加入适量水,并滴入稀硫酸与晶须反应,生成的CO2被NaOH溶液吸收,在室温下反应4~5h,反应后期将温度升到30℃,最后将烧杯中的溶液用已知浓度的盐酸滴定,测得CO2的总量;重复上述操作2次。
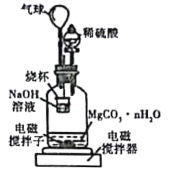
①图中气球的作用是_________。
②上述反应后期要升温到30℃,主要目的是______。
③测得每7.8000g碳酸镁晶须产生标准状况下CO2为1.12L,则n值为_______。
(3)碳酸镁晶须可由菱镁矿获得,为测定某菱镁矿(主要成分是碳酸镁,含少量碳酸亚铁、二氧化硅)中铁的含量,在实验室分别称取12.5g菱镁矿样品溶于过量的稀硫酸并完全转移到锥形瓶中,加入指示剂,用0.010mol/L H2O2溶液进行滴定。平行测定四组。消耗H2O2溶液的体积数据如表所示。
实验编号 | 1 | 2 | 3 | 4 |
消耗H2O2溶液体积/mL | 15.00 | 15.02 | 15.62 | 14.98 |
①H2O2溶液应装在_________(填“酸式”或“碱式”)滴定管中。
②根据表中数据,可计算出菱镁矿中铁元素的质量分数为_________ %(保留小数点后两位)。