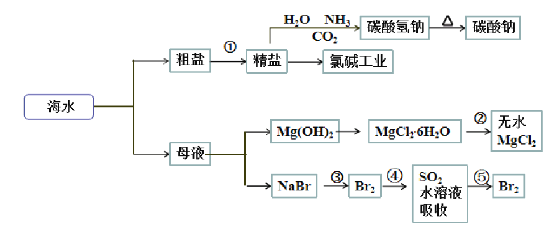
��Ŀ����
����Ŀ�����������ֳƹ�ʯ�����Ʊ��輰���軯�������Ҫԭ�ϡ�����ת��������ͼ��ʾ������˵����ȷ����
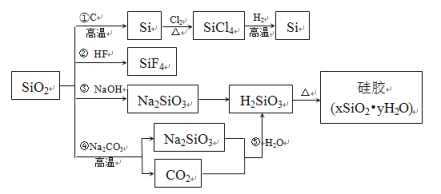
A.SiO2���ܷ����ڷ�Ӧ�����ܷ����۷�Ӧ��˵��SiO2��������������
B.�ܷ�Ӧ��ˮ�ҵ�Ļ�ѧ��Ӧԭ��֮һ���ݷ�Ӧ��֤��H2CO3����ǿ��H2SiO3
C.�ٷ�Ӧ���������Si���CO2���轺����������������
D.���˴ֹ���Ʊ����ᴿ�������漰�ķ�Ӧ�⣬ͼ����ʾ������Ӧ���Ƿ�������ԭ��Ӧ
���𰸡�D
��������
A. SiO2����HF��ӦSiF4��H2O������NaOH��Ӧ���ɹ����ƺ�����������������������Ķ��壬���������������A�����
B. SiO2��NaCO3�ķ�Ӧ�ǹ�ҵ���Ʋ����ķ�Ӧ����������CO2�ķ�Ӧ��������֤H2CO3����ǿ��H2SiO3��B�����
C. SiO2�ڸ�������C��Ӧ������Si���ʺ�CO�������в�����CO2��C�����
D. ���˴ֹ���Ʊ����ᴿ�������漰�ķ�Ӧ�⣬ͼ����ʾ������Ӧ���Ƿ�������ԭ��Ӧ��D����ȷ��
��ѡD��

 �����������Ů��ͯ������ϵ�д�
�����������Ů��ͯ������ϵ�д�����Ŀ����������ĵ���ƽ�ⳣ�������
���� | HCOOH | HClO | H2CO3 | H2SO3 |
����ƽ�� ������25�棩 | Ka��1.77��10��4 | Ka��4.0��10��8 | Ka1��4.3��10��7 Ka2��4.7��10��11 | Ka1��1.54��10��2 Ka2��1.02��10��7 |
��1�������¢�0.1mol��L-1HCOONa����0.1mol��L-1NaClO����0.1mol��L-1Na2CO3����0.1mol��L-1NaHCO3������Һ��pH�ɴ�С�Ĺ�ϵΪ________________�����������գ�
��2��Ũ�Ⱦ�Ϊ0.1 mol��L��1��Na2SO3��Na2CO3�Ļ����Һ�У�SO32-��CO32-��HSO3-��HCO3-Ũ�ȴӴ�С��˳��Ϊ________________��
��3���������ӷ���ʽ��ȷ����___________������ĸ����
A.2ClO-+H2O+CO2=2HClO+CO32- B.2HCOOH+CO32-=2HCOO-+H2O+CO2��
C.H2SO3+2HCOO-=2HCOOH+SO32- D.Cl2+H2O+2CO32-=2HCO3-+Cl-+ClO-
��4��ij�¶ȣ�T�棩�µ���Һ�У�c��H+��=10-xmol��L-1��c��OH-=10-ymol��L-1��x��y�Ĺ�ϵ��ͼ��ʾ��

�ٴ��¶��£�0.01mol/L��NaOH��Һ��ˮ�������OH-Ũ��Ϊ_______��
���ڴ��¶��£�0.1mol��L-1��NaHSO4��Һ��0.1mol��L-1��Ba(OH)2��Һ���±��мס��ҡ���������ͬ��ʽ��ϣ�
�� | �� | �� | �� | |
0.1mol��L-1��Ba��OH��2 | 10 | 10 | 10 | 10 |
0.1mol��L-1��NaHSO4 | 5 | 10 | 15 | 20 |
����ʽ��Ϻ�������Һ��pHΪ____________��
���ҷ�ʽ��Ϻ��䷴Ӧ�����ӷ���ʽ��_________________��
������ʽ��Ϻ�������Һ��____________����������������������������