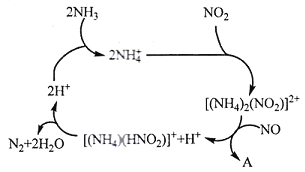
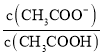题目内容
【题目】
过渡元素有特殊性能常用于合金冶炼,p区元素用于农药医药、颜料和光电池等工业。
(l)量子力学把电子在原子核外的一种空间运动状态称为一个原子轨道,电子除空间运动状态外,还有一种运动状态叫作_______
(2)基态亚铜离子中电子占据的原子轨道数目为____。
(3)Cr3+可以与CN -形成配离子,其中Cr3+以d2sp3方式杂化,杂化轨道全部用来与CN -形成配位键,则Cr3+的配位数为 ______,1 mol该配离子中含有_______ molσ键。
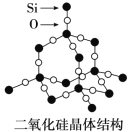
(4)单晶硅可由二氧化硅制得,二氧化硅晶体结构如图所示,在二氧化硅晶体中,Si、O原子所连接的最小环为____元环,则每个O原子连接________个最小环。
(5)与砷同周期的p区元素中第一电离能大于砷的元素有 ________(填元素符号);请根据物质结构的知识比较酸性强弱亚砷酸(H3AsO3,三元酸)____HNO3(填>,=,<)。
(6) Zn与S形成晶胞结构如图所示,晶体密度为p g/cm3,则晶胞中距离最近的Zn、S之间的核间距离是____pm。(NA表示阿伏加德罗常数,用含p、NA等的代数式表示)

【答案】自旋 14 6 12 12 6 Br、Kr < ![]() ×
×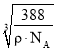 ×1010
×1010
【解析】
(1)对于一个微观体系,它的状态和由该状态所决定的各种物理性质可用波函数ψ表示,在原子或分子体系等体系中,将ψ称为原子轨道或分子轨道,求解薛定谔方程,ψ由主量子数n,角量子数l,磁量子数m决定,即ψ(n,l,m)为原子轨道,实验证明,除了轨道运动外,电子还有自旋运动,由自旋量子数决定;
(2)Cu原子核外电子排布式为1s22s22p63s23p63d104s1,失去4s能级1个电子形成Cu+;
(3) Cr3+可以与CN形成配离子,其中Cr3+以d2sp3方式杂化,杂化轨道全部用来与CN形成配位键,即形成6个配位键,则Cr3+的配位数为6,形成配离子为[Cr(CN)6]3,配位键属于σ键,CN中含有1个σ键;
(4)在二氧化硅晶体,可以看作在晶体硅中每个Si-Si键之间连接O原子,晶体Si中每个Si原子形成4个Si-Si键,由图可知每2个Si-Si键可以形成2个六元环,而4个Si-Si键任意2个可以形成6种组合;
(5)与砷同周期的p区元素中第一电离能大于砷的主族元素有Br和Kr;根据含氧酸中,酸的元数取决于羟基氢的个数,含非羟基氧原子个数越多,酸性越强;
(6)Zn、S的配位数相等,图中两种黑色球的数目均为4,则晶胞中Zn、S原子数目均为4,晶胞质量为4×![]() g,晶体密度为pg/cm3,则晶胞边长x=
g,晶体密度为pg/cm3,则晶胞边长x=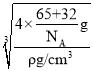 =
=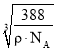 cm,即晶胞边长为x=
cm,即晶胞边长为x=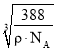 ×1010pm,S原子与周围4个Zn原子形成正四面体结构,令S与Zn之间的距离为y,则正四面体中心到底面中心的距离为
×1010pm,S原子与周围4个Zn原子形成正四面体结构,令S与Zn之间的距离为y,则正四面体中心到底面中心的距离为![]() ,正四面体的高为
,正四面体的高为![]() ,正四面体棱长=
,正四面体棱长=![]() ,则正四面体侧面的高为
,则正四面体侧面的高为![]() ×
×![]() ,底面中心到边的距离为
,底面中心到边的距离为![]() ×
×![]() ×
×![]() ,故(
,故(![]() )2+(
)2+(![]() ×
×![]() ×
×![]() )2=(
)2=(![]() ×
×![]() )2,整理得y=
)2,整理得y=![]() 。
。
(1)对于一个微观体系,它的状态和由该状态所决定的各种物理性质可用波函数ψ表示,在原子或分子体系等体系中,将ψ称为原子轨道或分子轨道,求解薛定谔方程ψ,由主量子数n,角量子数l,磁量子数m决定,即ψ(n,l,m)为原子轨道,实验证明,除了轨道运动外,电子还有自旋运动,由自旋量子数决定,所以电子除空间运动状态外,还有一种运动状态叫做自旋,
故答案为:自旋;
(2) Cu原子核外电子排布式为1s22s22p63s23p63d104s1,失去4s能级1个电子形成Cu+,Cu+基态时电子排布式为1s22s22p63s23p63d10,其电子占据的14原子轨道;
(3) Cr3+可以与CN形成配离子,其中Cr3+以d2sp3方式杂化,杂化轨道全部用来与CN形成配位键,即形成6个配位键,则Cr3+的配位数为6,形成配离子为[Cr(CN)6]3,配位键属于σ键,CN中含有1个σ键,故1mol该配离子中含有12molσ键;
(4) 在二氧化硅晶体,可以看作在晶体硅中每个SiSi键之间连接O原子,晶体Si中每个Si原子形成4个SiSi键,由图可知每2个SiSi键可以形成2个六元环,而4个SiSi键任意2个可以形成6种组合,则每个Si原子连接十二元环数目为6×2=12,每个O原子连接2个Si原子,每个Si原子和该O原子能形成3个最小环,所以每个O原子能形成6个最小环;
(5)As处于周期表中第4周期第ⅤA族,则其核外电子排布式为:[Ar]3d104s24p3,与砷同周期的p区元素中第一电离能大于砷的主族元素有Br和Kr;根据含氧酸中,酸的元数取决于羟基氢的个数,含非羟基氧原子个数越多,酸性越强;亚砷酸(H3AsO3)中含有3个羟基氢,为三元酸,没有非羟基氧原子,HNO3为一元酸,含有一个羟基氢,含非羟基氧原子2个,所以酸性:H3AsO3< HNO3;
(6) Zn、S的配位数相等,图中两种黑色球的数目均为4,则晶胞中Zn、S原子数目均为4,晶胞质量为4×![]() g,晶体密度为pg/cm3,则晶胞边长x=
g,晶体密度为pg/cm3,则晶胞边长x=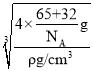 =
=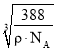 cm,即晶胞边长为x=
cm,即晶胞边长为x=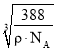 ×1010pm,S原子与周围4个Zn原子形成正四面体结构,令S与Zn之间的距离为y,则正四面体中心到底面中心的距离为
×1010pm,S原子与周围4个Zn原子形成正四面体结构,令S与Zn之间的距离为y,则正四面体中心到底面中心的距离为![]() ,正四面体的高为
,正四面体的高为![]() ,正四面体棱长=
,正四面体棱长=![]() ,则正四面体侧面的高为
,则正四面体侧面的高为![]() ×
×![]() ,底面中心到边的距离为
,底面中心到边的距离为![]() ×
×![]() ×
×![]() ,故(
,故(![]() )2+(
)2+(![]() ×
×![]() ×
×![]() )2=(
)2=(![]() ×
×![]() )2,整理得y=
)2,整理得y=![]() ,故S与Zn的距离为
,故S与Zn的距离为![]() ×
×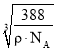 ×1010 pm,
×1010 pm,
故答案为:![]() ×
×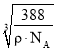 ×1010。
×1010。

【题目】某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择甲基橙作指示剂。请回答下列问题:
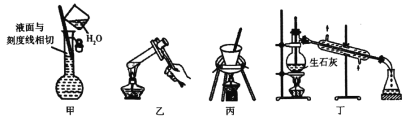
(1)观察图,标准液盐酸应放入__滴定管中。(填“甲”或“乙”)

(2)用标准的盐酸滴定待测的NaOH溶液时,左手握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视__,滴定终点的现象为__。
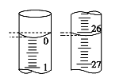
(3)若滴定开始和结束时,酸式滴定管中的液面如图所示,则起始读数为__mL,所用盐酸溶液的体积为___mL。
(4)某学生根据3次实验分别记录有关数据如表所示:
滴定次数 | 待测NaOH溶液的体积 | 0.1000mol/L盐酸的体积/mL | ||
滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
依据表中数据计算该NaOH溶液的物质的量浓度__。
(5)下列操作中可能使所测NaOH溶液的浓度数值偏低的是__(填字母序号)。
A.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸
B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
【题目】某无色溶液中只可能含有![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 离子中的若干种,依次进行下列实验,且每步所加试剂均过量,观察到的现象如下:下列结论正确的是
离子中的若干种,依次进行下列实验,且每步所加试剂均过量,观察到的现象如下:下列结论正确的是
步骤 | 操作 | 现象 |
| 用pH试纸检验 | 溶液的pH大于7 |
| 向溶液中滴加氯水,再加入 |
|
| 向 | 有白色沉淀产生 |
| 过滤,向滤液中加入 | 有白色沉淀产生 |
A.肯定含有离子的![]() 、
、![]() 、
、![]()
B.肯定没有的离子是![]() 、
、![]()
C.可能含有的离子是![]() 、
、![]() 、
、![]()
D.不能确定的离子是![]() 、
、![]() 、
、![]()