题目内容
15.合成氨工业有下列生产流程,其先后顺序为( )①原料气制备 ②氨的合成 ③原料气净化和压缩 ④氨的分离.
| A. | ①②③④ | B. | ①③②④ | C. | ④③②① | D. | ②③④① |
分析 合成氨工业有下列流程:原料气制备、原料气净化和压缩、氨的合成、氨的分离,以此来解答.
解答 解:因合成氨工业有下列流程:原料气制备、原料气净化和压缩、氨的合成、氨的分离,
故选B.
点评 本题主要考查了合成氨工业,掌握合成氨工业的流程即可完成,难度不大.

练习册系列答案
相关题目
5.卤族元素的单质和化合物很多我们可以利用所学物质结构与性质的相关知识去认识和理解它们.
(1)卤族元素位于周期表的p区;溴的价电子排布式为4s24p5.
(2)在不太稀的溶液中,氢氟酸是以二分子缔合(HF)2形式存在的.使氢氟酸分子缔合的作用力是氢键.
(3)请根据如表提供的第一电离能数据判断:最有可能生成较稳定的单核阳离子的卤素原子是I.
(4)已知高碘酸有两种形式,化学式分别为H5IO6(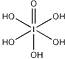 )和HIO4,前者为五元酸,后者为一元酸.请比较二者酸性强弱:H5IO6<HIO4.(填“>”、“<”或“=”)
)和HIO4,前者为五元酸,后者为一元酸.请比较二者酸性强弱:H5IO6<HIO4.(填“>”、“<”或“=”)
(5)已知ClO2-为角型,中心氯原子周围有四对价层电子.ClO2-中心氯原子的杂化轨道类型为sp3
(6)写出一个ClO2-的等电子体Cl2O或OF2.
(1)卤族元素位于周期表的p区;溴的价电子排布式为4s24p5.
(2)在不太稀的溶液中,氢氟酸是以二分子缔合(HF)2形式存在的.使氢氟酸分子缔合的作用力是氢键.
(3)请根据如表提供的第一电离能数据判断:最有可能生成较稳定的单核阳离子的卤素原子是I.
| 氟 | 氯 | 溴 | 碘 | 铍 | |
| 第一电离能(kJ/mol) | 1681 | 1251 | 1140 | 1008 | 900 |
 )和HIO4,前者为五元酸,后者为一元酸.请比较二者酸性强弱:H5IO6<HIO4.(填“>”、“<”或“=”)
)和HIO4,前者为五元酸,后者为一元酸.请比较二者酸性强弱:H5IO6<HIO4.(填“>”、“<”或“=”)(5)已知ClO2-为角型,中心氯原子周围有四对价层电子.ClO2-中心氯原子的杂化轨道类型为sp3
(6)写出一个ClO2-的等电子体Cl2O或OF2.
6.下列说法正确的是( )
| A. | 硫酸的摩尔质量为98g | |
| B. | 3.01×1023个SO2分子的质量为32g | |
| C. | 1 mol H2O的质量为18g/mol | |
| D. | 1mol任何物质实际都约含有6.02×1023个原子 |
3.下列物质:①KMnO4 ②HCHO(甲醛) ③MgSO4 ④NH4Cl ⑤KOH ⑥Hg(NO3)2中,能使蛋白质变性的是( )
| A. | ②④⑥ | B. | ①③⑤ | C. | ①②③⑥ | D. | ①②⑤⑥ |
20.对溶液中的反应,如图图象中m表示生成沉淀或气体的物质的量,n表示滴加的某一种反应物的物质的量,则下列叙述中正确的是( )
| A. |  符合此图象的可以向NaAlO2溶液中逐滴加入盐酸 | |
| B. | 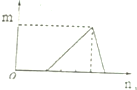 符合此图象的可以是向含有盐酸的AlCl3溶液中滴加NaOH溶液 | |
| C. | 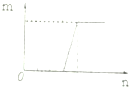 符合此图象的可以是向含有等物质的量的NaOH和Na2CO3溶液中滴加盐酸 | |
| D. | 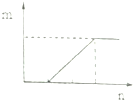 符合此图象的向含有等物质的量的NaHCO3和Na2CO3的溶液中滴加盐酸 |
16.(1)在NaOH溶液中通入一定量的CO2后,溶液中溶质的组成可能是①Na2CO3和NaOH,②Na2CO3,③Na2CO3和NaHCO3,④NaHCO3.
(2)现有甲、乙两瓶无色溶液,已知它们可能为AlCl3溶液和NaOH溶液.现分别将一定体积的甲、乙两溶液混合,具体情况如下表所示,请回答:
①甲瓶溶液为AlCl3溶液.
②乙瓶溶液为NaOH溶液,其物质的量浓度为0.5mol•L-1.
(2)现有甲、乙两瓶无色溶液,已知它们可能为AlCl3溶液和NaOH溶液.现分别将一定体积的甲、乙两溶液混合,具体情况如下表所示,请回答:
| 实验① | 实验② | 实验③ | |
| 取甲瓶溶液的量 | 400mL | 120mL | 120mL |
| 取乙瓶溶液的量 | 120mL | 440mL | 400mL |
| 生成沉淀的量 | 1.56g | 1.56g | 3.12g |
②乙瓶溶液为NaOH溶液,其物质的量浓度为0.5mol•L-1.
17.下列说法正确的是( )
| A. | 体心立方是金属最密堆积形式 | |
| B. | 24g金刚石中含有C-C键的个数为4NA | |
| C. | NaCl晶体中Na+的配位数为4 | |
| D. | 中和热测定时,用铜棒代替环形玻璃棒会导致△H偏低 |