题目内容
20.对溶液中的反应,如图图象中m表示生成沉淀或气体的物质的量,n表示滴加的某一种反应物的物质的量,则下列叙述中正确的是( )| A. |  符合此图象的可以向NaAlO2溶液中逐滴加入盐酸 | |
| B. | 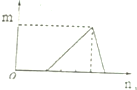 符合此图象的可以是向含有盐酸的AlCl3溶液中滴加NaOH溶液 | |
| C. | 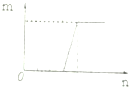 符合此图象的可以是向含有等物质的量的NaOH和Na2CO3溶液中滴加盐酸 | |
| D. | 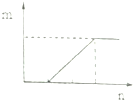 符合此图象的向含有等物质的量的NaHCO3和Na2CO3的溶液中滴加盐酸 |
分析 A、向NaAlO2溶液中逐滴加入盐酸至过量,偏铝酸钠先与盐酸反应生成氢氧化铝沉淀,然后氢氧化铝再与盐酸发生酸碱中和生成氯化铝,沉淀完全溶解;
B、向含有盐酸的AlCl3溶液中滴加NaOH溶液,先是和盐酸发生中和反应,然后氢氧化钠和氯化铝反应产生沉淀,最后,沉淀完全消失;
C、向含有等物质的量的NaOH和Na2CO3溶液中滴加盐酸,先是NaOH和盐酸发生中和反应,然后盐酸和碳酸钠反应产生碳酸氢钠,最后是碳酸氢钠和盐酸反应产生二氧化碳;
D、含有等物质的量的NaHCO3和Na2CO3的溶液中滴加盐酸,先发生:NaHCO3+HCl=NaCl+H2O+CO2↑,后盐酸和碳酸钠反应产生碳酸氢钠,最后是碳酸氢钠和盐酸反应产生二氧化碳.
解答 解:A、向NaAlO2溶液中逐滴加入盐酸至过量,偏铝酸钠先与盐酸反应生成氢氧化铝沉淀,NaAlO2~HCl~Al(OH)3,然后氢氧化铝再与盐酸发生酸碱中和生成氯化铝,Al(OH)3~3HCl,沉淀完全溶解,产生最大量沉淀消耗盐酸的量和沉淀完全溶解消耗盐酸的量之比是1:3,故A错误;
B、向含有盐酸的AlCl3溶液中滴加NaOH溶液,先是和盐酸发生中和反应,HCl+NaOH=NaCl+H2O,然后氢氧化钠和氯化铝反应产生沉淀,AlCl3~3NaOH~Al(OH)3,最后,沉淀完全消失Al(OH)3~NaOH,图象符合过程量的情况,故B正确;
C、向含有等物质的量的NaOH和Na2CO3溶液中滴加盐酸,先是NaOH和盐酸发生中和反应,HCl+NaOH=NaCl+H2O,然后盐酸和碳酸钠反应产生碳酸氢钠,Na2CO3+HCl=NaHCO3+NaCl,最后是碳酸氢钠和盐酸反应产生二氧化碳NaHCO3+HCl=NaCl+H2O+CO2↑,三阶段盐酸的量之比是1:1:1,故C错误;
D、含有等物质的量的NaHCO3和Na2CO3的溶液中滴加盐酸,先发生:NaHCO3+HCl=NaCl+H2O+CO2↑,后盐酸和碳酸钠反应产生碳酸氢钠,最后是碳酸氢钠和盐酸反应产生二氧化碳,图象和过程不符,故D错误.
故选B.
点评 本题涉及物质的性质以及反应的先后顺序知识,注意反应方程式的书写和物质量的关系是关键,难度中等.

| A. | 6:1 | B. | 5:1 | C. | 3:1 | D. | 2:1 |
| A. | 气体的摩尔体积即标准状况下单位物质的量气体的体积 | |
| B. | 温度压强一定的情况下,气体的体积决定于气体的物质的量多少和分子本身的大小 | |
| C. | 配制物质的量浓度的溶液,定容时俯视,配得溶液浓度偏大 | |
| D. | 电解18g水,两极生成的气体体积比约为2:1,质量比2:16 |
①原料气制备 ②氨的合成 ③原料气净化和压缩 ④氨的分离.
| A. | ①②③④ | B. | ①③②④ | C. | ④③②① | D. | ②③④① |
(1)浓盐酸的物质的量浓度为12.5mol.l-1.
(2)配制240mL 0.1mol•L-1的盐酸
| 应量取浓盐酸体积/mL | 应选用容量瓶的规格/mL |
A.用30mL水洗涤烧杯和玻璃杯2-3次,洗涤液均注人容量瓶,振荡
B.用量筒准确量取所需的浓盐酸的体积,沿玻璃棒倒入烧杯中,再加人少量水(约30mL),用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注人容量瓶中
D.将容最瓶盖紧,振荡、摇匀
E.改用胶头滴管加水,使溶液凹液面最低处恰好与刻度线相切
F.继续往容量瓶内小心加水,直到液面距离刻度线1-2cm处
(4)操作A中,将洗涤液都移人容量瓶,其目的是保证溶质全部转移到容量瓶.
请回答下列问题:
| W | X | Y |
| Z |
(2)W、X、Y三种元素中,原子半径最大的是C;其氢化物中最稳定的是H2O,既含有极性共价键又含有非极性共价键的是H2O2 等.(任写一种,均写化学式)
(3)由W、Y和Z三种元素组成的化合物WYZ中,所有原子的最外层都满足8电子结构,写出该化合物的电子式:
 .
. | A. | 可以使酸性重铬酸钾溶液褪色 | B. | 可由乙烯通过加成反应获得 | ||
| C. | 与二甲醚互为同分异构体 | D. | 通过取代反应可制取乙酸乙酯 |