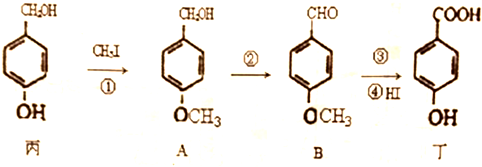
题目内容
16.(1)在NaOH溶液中通入一定量的CO2后,溶液中溶质的组成可能是①Na2CO3和NaOH,②Na2CO3,③Na2CO3和NaHCO3,④NaHCO3.(2)现有甲、乙两瓶无色溶液,已知它们可能为AlCl3溶液和NaOH溶液.现分别将一定体积的甲、乙两溶液混合,具体情况如下表所示,请回答:
| 实验① | 实验② | 实验③ | |
| 取甲瓶溶液的量 | 400mL | 120mL | 120mL |
| 取乙瓶溶液的量 | 120mL | 440mL | 400mL |
| 生成沉淀的量 | 1.56g | 1.56g | 3.12g |
②乙瓶溶液为NaOH溶液,其物质的量浓度为0.5mol•L-1.
分析 (1)由CO2+2NaOH═Na2CO3+H2O、CO2+NaOH═NaHCO3,及气体的量确定固体的成分;
(2)氯化铝滴入NaOH溶液中,开始氢氧化钠过量,开始发生反应:AlCl3+4NaOH═NaAlO2+3NaCl+2H2O,然后发生反应:3NaAlO2+AlCl3+6H2O=4Al(OH)3↓+3NaCl;
氢氧化钠溶液滴入AlCl3溶液中,开始发生反应:AlCl3+3NaOH═Al(OH)3↓+3NaCl,然后发生反应:Al(OH)3+NaOH═NaAlO2+2H2O,
由②和③可知,一定量的甲与乙反应时,乙的量越多,生成的沉淀越少,则乙为NaOH溶液,即甲为AlCl3溶液;
由实验①②可知,实验①中NaOH不足,AlCl3有剩余,根据AlCl3+3NaOH═Al(OH)3↓+3NaCl,计算NaOH溶液的物质的量,进而计算NaOH的浓度.
解答 解:(1)由CO2+2NaOH═Na2CO3+H2O、CO2+NaOH═NaHCO3,二氧化碳少量时固体为①Na2CO3和NaOH;以1:2恰好反应时为②Na2CO3;物质的量比介于1:1~1:2之间为③Na2CO3和NaHCO3;二氧化碳过量时为④NaHCO3,
故答案为:Na2CO3和NaOH;Na2CO3;Na2CO3和NaHCO3;NaHCO3;
(2)氯化铝滴入NaOH溶液中,开始氢氧化钠过量,开始发生反应:AlCl3+4NaOH═NaAlO2+3NaCl+2H2O,然后发生反应:3NaAlO2+AlCl3+6H2O=4Al(OH)3↓+3NaCl;
氢氧化钠溶液滴入AlCl3溶液中,开始发生反应:AlCl3+3NaOH═Al(OH)3↓+3NaCl,然后发生反应:Al(OH)3+NaOH═NaAlO2+2H2O,
由②和③可知,一定量的甲与乙反应时,乙的量越多,生成的沉淀越少,则乙为NaOH溶液,即甲为AlCl3溶液,乙为NaOH溶液,
由实验①②可知,实验①中NaOH不足,AlCl3有剩余,根据AlCl3+3NaOH═Al(OH)3↓+3NaCl,1.56g沉淀的物质的量为$\frac{1.56g}{78g/mol}$=0.02mol,则NaOH的物质的量为0.02mol×3=0.06mol,故NaOH溶液的物质的量浓度为$\frac{0.06mol}{0.12L}$=0.5mol/L,
故答案为:①AlCl3;②NaOH;0.5.
点评 本题考查化学方程式有关计算,(2)正确判断甲、乙成分是解题关键,侧重考查学生对数据的分析处理能力,难度较大.

 学习实践园地系列答案
学习实践园地系列答案| A. | pH>7时,c(C6H5O-)>c(K+)>c(H+)>c(OH-) | |
| B. | V[C6H5OH(aq)]=20mL时,c(C6H5O-)+c(C6H5OH)=2c(K+) | |
| C. | pH<7时,c(K+)>c(C6H5O-)>c(H+)>c(OH-) | |
| D. | V[C6H5OH(aq)]=10mL时,c(K+)=c(C6H5O-)>c(OH-)=c(H+) |
①原料气制备 ②氨的合成 ③原料气净化和压缩 ④氨的分离.
| A. | ①②③④ | B. | ①③②④ | C. | ④③②① | D. | ②③④① |
(1)浓盐酸的物质的量浓度为12.5mol.l-1.
(2)配制240mL 0.1mol•L-1的盐酸
| 应量取浓盐酸体积/mL | 应选用容量瓶的规格/mL |
A.用30mL水洗涤烧杯和玻璃杯2-3次,洗涤液均注人容量瓶,振荡
B.用量筒准确量取所需的浓盐酸的体积,沿玻璃棒倒入烧杯中,再加人少量水(约30mL),用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注人容量瓶中
D.将容最瓶盖紧,振荡、摇匀
E.改用胶头滴管加水,使溶液凹液面最低处恰好与刻度线相切
F.继续往容量瓶内小心加水,直到液面距离刻度线1-2cm处
(4)操作A中,将洗涤液都移人容量瓶,其目的是保证溶质全部转移到容量瓶.
| A. | 过氧化钠固体与水反应:2O22-+2H2O═4OH-+O2↑ | |
| B. | 向明矾[KAl(SO4)2]溶液中逐滴加入Ba(OH)2溶液至SO42-恰好沉淀完全:2Al3++3SO42-+3Ba2++6OH-═2Al(OH)3↓+3BaSO4↓ | |
| C. | 铁与足量的稀硝酸溶液反应放出NO气体:Fe+4H++NO3-═Fe3++2H2O+NO↑ | |
| D. | 溴化亚铁溶液与少量氯水混合:2Fe2++4Br-+3Cl2═2Fe3++6Cl-+2Br2 |
请回答下列问题:
| W | X | Y |
| Z |
(2)W、X、Y三种元素中,原子半径最大的是C;其氢化物中最稳定的是H2O,既含有极性共价键又含有非极性共价键的是H2O2 等.(任写一种,均写化学式)
(3)由W、Y和Z三种元素组成的化合物WYZ中,所有原子的最外层都满足8电子结构,写出该化合物的电子式:
 .
. | A. | 2NaNO3$\frac{\underline{\;\;△\;\;}}{\;}$2NaNO2+O2↑ | B. | SO2+2H2S═S+2H2O | ||
| C. | 3Cl2+6KOH═5KCl+KClO3+3H2O | D. | NH4NO3$\frac{\underline{\;\;△\;\;}}{\;}$N2O↑+2H2O |