题目内容
7.将28g Fe粉和8g硫粉隔绝空气混合加热,充分反应后冷却至室温,再加入足量的稀H2SO4,可产生标准状况下的气体的体积是多少升?分析 加热发生反应Fe+S$\frac{\underline{\;\;△\;\;}}{\;}$FeS,加入盐酸一定发生反应FeS+2HCl=FeCl2+H2S↑,而Fe与盐酸反应为Fe+2HCl=FeCl2+H2↑,由方程式可知加热过程中Fe无论过量与否,与盐酸反应最终得到的气体的物质的量等于原混合物中Fe的物质的量,再根据V=nVm计算生成气体的体积.
解答 解:加热发生反应Fe+S $\frac{\underline{\;\;△\;\;}}{\;}$FeS,加入盐酸一定发生反应FeS+2HCl=FeCl2+H2S↑,而Fe与盐酸反应为Fe+2HCl=FeCl2+H2↑,由方程式可知加热过程中Fe无论过量与否,与盐酸反应最终得到的气体的物质的量等于原混合物中Fe的物质的量,故n(气体)=n(Fe)=$\frac{28g}{56g/mol}$=0.5mol,气体体积为0.5mol×22.4L/mol=11.2L,
答:可产生标准状况下的气体的体积是11.2升.
点评 本题考查学生铁和硫反应的计算知识,注意方程式的书写和应用是关键,难度中等.

练习册系列答案
 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案
相关题目
17.现有部分短周期元素的性质或原子结构如下表:
①元素X的一种同位素可测定文物年代,这种同位素的符号是 14C.
②T的氢化物一个分子中核外共有18个电子,其结构式为H-S-H;
③Y的氢化物与Y的最高价氧化物的水化物反应生成的物质名称为:硝酸铵
④T与X形成的常见化合物的电子式为: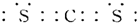 ;
;
⑤Z所在族元素的氢化物中,沸点最低的物质的化学式为:HCl
⑥元素Z与元素T相比,非金属性较强的是Cl(用元素符号表示),下列表述中能证明这一事实的是b.
a.常温下Z单质的熔沸点比T单质的熔沸点低
b.Z的氢化物比T的氢化物稳定
c.一定条件下Z和T的单质都能与氢氧化钠溶液反应
d.T元素原子得电子的数目比Z元素原子得电子多.
| 元素编号 | 元素性质或原子结构 |
| T | 最外层电子占核外电子总数的$\frac{3}{8}$ |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 元素最高正价是+7价 |
②T的氢化物一个分子中核外共有18个电子,其结构式为H-S-H;
③Y的氢化物与Y的最高价氧化物的水化物反应生成的物质名称为:硝酸铵
④T与X形成的常见化合物的电子式为:
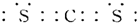 ;
;⑤Z所在族元素的氢化物中,沸点最低的物质的化学式为:HCl
⑥元素Z与元素T相比,非金属性较强的是Cl(用元素符号表示),下列表述中能证明这一事实的是b.
a.常温下Z单质的熔沸点比T单质的熔沸点低
b.Z的氢化物比T的氢化物稳定
c.一定条件下Z和T的单质都能与氢氧化钠溶液反应
d.T元素原子得电子的数目比Z元素原子得电子多.
15.合成氨工业有下列生产流程,其先后顺序为( )
①原料气制备 ②氨的合成 ③原料气净化和压缩 ④氨的分离.
①原料气制备 ②氨的合成 ③原料气净化和压缩 ④氨的分离.
| A. | ①②③④ | B. | ①③②④ | C. | ④③②① | D. | ②③④① |
4.实验室用密度为1.25g•L-1溶质质量分数为36.5%的浓盐酸配制240mL0.1mol•L-1的盐酸,请问答下列问题:
(1)浓盐酸的物质的量浓度为12.5mol.l-1.
(2)配制240mL 0.1mol•L-1的盐酸
(3)配制时,正确的操作顺序是BCAFED(用字母表示,位个字母只能用一次,并将步骤A,E补充完整)
A.用30mL水洗涤烧杯和玻璃杯2-3次,洗涤液均注人容量瓶,振荡
B.用量筒准确量取所需的浓盐酸的体积,沿玻璃棒倒入烧杯中,再加人少量水(约30mL),用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注人容量瓶中
D.将容最瓶盖紧,振荡、摇匀
E.改用胶头滴管加水,使溶液凹液面最低处恰好与刻度线相切
F.继续往容量瓶内小心加水,直到液面距离刻度线1-2cm处
(4)操作A中,将洗涤液都移人容量瓶,其目的是保证溶质全部转移到容量瓶.
(1)浓盐酸的物质的量浓度为12.5mol.l-1.
(2)配制240mL 0.1mol•L-1的盐酸
| 应量取浓盐酸体积/mL | 应选用容量瓶的规格/mL |
A.用30mL水洗涤烧杯和玻璃杯2-3次,洗涤液均注人容量瓶,振荡
B.用量筒准确量取所需的浓盐酸的体积,沿玻璃棒倒入烧杯中,再加人少量水(约30mL),用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注人容量瓶中
D.将容最瓶盖紧,振荡、摇匀
E.改用胶头滴管加水,使溶液凹液面最低处恰好与刻度线相切
F.继续往容量瓶内小心加水,直到液面距离刻度线1-2cm处
(4)操作A中,将洗涤液都移人容量瓶,其目的是保证溶质全部转移到容量瓶.
11.下列反应的离子方程式正确的是( )
| A. | 过氧化钠固体与水反应:2O22-+2H2O═4OH-+O2↑ | |
| B. | 向明矾[KAl(SO4)2]溶液中逐滴加入Ba(OH)2溶液至SO42-恰好沉淀完全:2Al3++3SO42-+3Ba2++6OH-═2Al(OH)3↓+3BaSO4↓ | |
| C. | 铁与足量的稀硝酸溶液反应放出NO气体:Fe+4H++NO3-═Fe3++2H2O+NO↑ | |
| D. | 溴化亚铁溶液与少量氯水混合:2Fe2++4Br-+3Cl2═2Fe3++6Cl-+2Br2 |
8.同种物质中同一价态的元素部分被氧化,部分被还原的氧化还原反应是( )
| A. | 2NaNO3$\frac{\underline{\;\;△\;\;}}{\;}$2NaNO2+O2↑ | B. | SO2+2H2S═S+2H2O | ||
| C. | 3Cl2+6KOH═5KCl+KClO3+3H2O | D. | NH4NO3$\frac{\underline{\;\;△\;\;}}{\;}$N2O↑+2H2O |