题目内容
10.现有标准状况下的35.5g Cl2,回答下列问题:(1)其体积约为11.2L;
(2)将其与H2在点燃条件完全化合生成HCl,此反应的化学方程式为:H2+Cl2$\frac{\underline{\;点燃\;}}{\;}$2HCl;
(3)此反应中电子转移的数目约为6.02×1023个;
(4)生成的HCl的物质的量为1mol
(5)将生成的HCl全部溶于水配成溶液,则完全中和这些HCl需要浓度为10mol/L NaOH的体积为100mL.
分析 (1)标准状况下,Vm=22.4L/mol,利用n=$\frac{m}{M}$、V=n×Vm来计算;
(2)根据反应物和生成物来书写化学反应方程式;
(3)根据化合价的变化来计算转移的电子数;
(4)根据Cl原子守恒来计算生成的HCl的物质的量;
(5)根据HCl+NaOH=NaCl+H2O来计算.
解答 解:(1)Cl2的物质的量为$\frac{35.5g}{71g/mol}$=0.5mol,其标况下的体积为0.5mol×22.4L/mol=11.2L,故答案为:11.2;
(2)Cl2与H2完全化合生成HCl,反应为H2+Cl2$\frac{\underline{\;点燃\;}}{\;}$2HCl,故答案为:H2+Cl2$\frac{\underline{\;点燃\;}}{\;}$2HCl;
(3)Cl元素的化合价由0降低为-1价,则该反应中转移的电子数为0.5×2×(1-0)×NA=6.02×1023,故答案为:6.02×1023;
(4)由Cl原子守恒可知Cl2~2HCl,则HCl的物质的量为0.5mol×2=1mol,故答案为:1;
(5)由HCl+NaOH=NaCl+H2O可知,完全中和时NaOH的物质的量为1mol,则NaOH的体积为$\frac{1mol}{10mol/L}$=0.1L=100mL,故答案为:100.
点评 本题考查学生有关物质的量、反应中转移电子数、物质的量浓度的计算,明确计算公式是解答本题的关键,难度不大,注重对基础知识的考查.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
5.我国卫生部门制定的《关于宣传吸烟有毒与控制吸烟》的通知中规定:“中学生不准吸烟”.香烟燃烧产生的烟气中,有多种有害物质,其中尼古丁对人体危害最大,尼古丁的分子式为C10H14N2. 下列说法正确的是( )
| A. | 尼古丁是由26个原子构成的物质 | |
| B. | 尼古丁中C、H、N三种元素的质量比为:10:14:2 | |
| C. | 尼古丁的相对分子质量是162g | |
| D. | 尼古丁中氮元素的质量分数为17.3% |
15.合成氨工业有下列生产流程,其先后顺序为( )
①原料气制备 ②氨的合成 ③原料气净化和压缩 ④氨的分离.
①原料气制备 ②氨的合成 ③原料气净化和压缩 ④氨的分离.
| A. | ①②③④ | B. | ①③②④ | C. | ④③②① | D. | ②③④① |
11.下列反应的离子方程式正确的是( )
| A. | 过氧化钠固体与水反应:2O22-+2H2O═4OH-+O2↑ | |
| B. | 向明矾[KAl(SO4)2]溶液中逐滴加入Ba(OH)2溶液至SO42-恰好沉淀完全:2Al3++3SO42-+3Ba2++6OH-═2Al(OH)3↓+3BaSO4↓ | |
| C. | 铁与足量的稀硝酸溶液反应放出NO气体:Fe+4H++NO3-═Fe3++2H2O+NO↑ | |
| D. | 溴化亚铁溶液与少量氯水混合:2Fe2++4Br-+3Cl2═2Fe3++6Cl-+2Br2 |
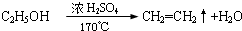
12.既可以用来鉴别甲烷和乙烯,又可以用来除去甲烷中混有的乙烯,得到较纯净的甲烷的方法是( )
| A. | 与足量溴水反应 | B. | 通入酸性高锰酸钾溶液中 | ||
| C. | 在一定条件下通入氢气 | D. | 将其分别点燃 |