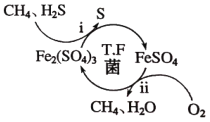
题目内容
【题目】粘合剂M的合成路线如下图所示:
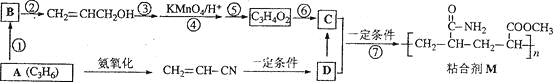
完成下列填空:
1)写出A和B的结构简式。
A___________B_______________
2)写出反应类型。反应⑥______________反应⑦______________
3)写出反应条件。反应②______________反应⑤______________
4)反应③和⑤的目的是____________________。
5)C的具有相同官能团的同分异构体共有________________种。
6)写出D在碱性条件下水解的反应方程式。
____________________________
【答案】CH3CH=CH2 CH2=CHCH2Cl 酯化反应 加聚反应 NaOH、H2O、加热 NaOH、乙醇、加热 保护碳碳双键 4 ![]()
【解析】
A的分子式为C3H6,能氨氧化生成CH2=CHCN,故A为CH3CH=CH2,A反应生成B,B能转化为CH2=CHCH2OH,故B为CH2=CHCH2Cl(或CH2=CHCH2Br),CH2=CHCH2OH经系列转化生成C3H4O2,可知C3H4O2中含有-COOH,C3H4O2的不饱和度为![]() =2,故C3H4O2中还含有C=C双键,C3H4O2的结构简式为CH2=CHCOOH,反应③和⑤的目的是保护C=C双键,根据粘合剂M的结构简式可知,其单体为CH2=CHCOOCH3、CH2=CHCONH2,故C为CH2=CHCOOCH3,D为CH2=CHCONH2,据此解答。
=2,故C3H4O2中还含有C=C双键,C3H4O2的结构简式为CH2=CHCOOH,反应③和⑤的目的是保护C=C双键,根据粘合剂M的结构简式可知,其单体为CH2=CHCOOCH3、CH2=CHCONH2,故C为CH2=CHCOOCH3,D为CH2=CHCONH2,据此解答。
(1)通过以上分析知,A的结构简式为:CH3CH=CH2,B的结构简式为:CH2=CHCH2Cl(或CH2=CHCH2Br);
答案为:CH3CH=CH2;CH2=CHCH2Cl(或CH2=CHCH2Br);
(2)通过以上分析知,丙烯酸和甲醇发生酯化反应生成丙烯酸甲酯,所以该反应是酯化反应;CH2=CHCOOCH3和CH2=CHCONH2反应生成粘合剂M,发生的是加聚反应;
答案为:酯化反应;加聚反应;
(3)在加热条件下,CH2=CHCH2Cl和氢氧化钠的水溶液发生取代反应生成丙烯醇;在加热条件下,连接醇羟基碳原子相邻的碳原子上含有氢原子,则含有醇羟基的物质在氢氧化钠的醇溶液里能发生消去反应;
答案为:NaOH、H2O、加热;NaOH、醇、加热;
(4)通过以上分析知,其目的是保护碳碳双键;
答案为:保护碳碳双键;
(5)C的同分异构体中,具有与C相同官能团的共有HCOOCH2CH=CH2、HCOOCH=CHCH3、HCOOC(CH3)=CH2、CH3COOCH=CH2,所以共有4种。
答案为:4;
(6)CH2=CHCONH2在碱性条件下水解的反应方程式为:![]() 。
。
答案为:![]() 。
。

【题目】在化学课上围绕浓硫酸的化学性质进行了如下实验探究,将适量的蔗糖放入烧杯中,加入几滴水,搅拌均匀,然后加入浓硫酸,生成黑色物质。
请回答下列问题:
(1)生成的黑色物质(单质)是_____(填化学式)。
(2)这种黑色物质继续与浓硫酸作用会产生两种气体,其中一种气体有刺激性气味,是大气的主要污染物之一,这种刺激性气味的气体成分是_______(填化学式),反应的化学方程式为_________。
(3)据蔗糖与浓硫酸反应的实验现象,说明浓硫酸具有___________(填序号)。
A.酸性 | B.吸水性 | C.脱水性 | D.强氧化性 |
(4)将(2)中产生的有刺激性气味的气体通入品红溶液中,可以看到品红溶液_______,说明这种气体具有_______性;将(2)中产生的有刺激性气味的气体通入水中可生成一种不稳定、易分解的酸,请写出该反应的化学方程式:__________________________________________。
(5)能否用澄清石灰水鉴别这两种气体?_______(填“能”或“不能”),若不能,请填写两种能鉴别的试剂____________。