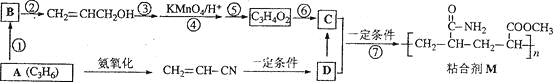
题目内容
【题目】短周期主族元素X、Y、Z、W的原子序数依次增大,X原子的最外层电子数是次外层的3倍,金属元素Y原子核外无未成对电子, Z的单质晶体是应用最广泛的半导体材料,W与X位于同一主族。下列说法不正确的是
A.W的最高价氧化物对应的水化物是强酸
B.X的简单气态氢化物的沸点比W的高
C.Y的第一电离能比同周期相邻元素的大
D.1mol单质Z中共价键的数目约为4×6.02×1023
【答案】D
【解析】
短周期主族元素X、Y、Z、W的原子序数依次增大,由X原子的最外层电子数是次外层的3倍可知,X为O元素;由金属元素Y原子核外无未成对电子可知,Y为Mg元素;由Z的单质晶体是应用最广泛的半导体材料可知,Z为Si元素;由W与X位于同一主族可知,W为S元素。
A.硫元素的最高价氧化物对应的水化物是硫酸,硫酸是二元强酸,故A正确;
B.水分子间能形成氢键,硫化氢分子间不能形成氢键,则水的的沸点比硫化氢高,故B正确;
C.同周期元素,从左到右,第一电离能有增大的趋势,镁的价电子排布式为3s2,3s轨道为全充满的稳定状态,第一电离能比同周期相邻元素的大,故C正确;
D.硅单质为原子晶体,一个硅原子周围有四个硅原子,每个硅原子形成共价键的数目为4×![]() =2,则1mol单质硅中共价键的数目约为2×6.02×1023,故D错误;
=2,则1mol单质硅中共价键的数目约为2×6.02×1023,故D错误;
故选D。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】在3个初始温度均为T℃的密闭容器中发生反应:2SO2(g)+O2(g)![]() 2SO3(g) (正反应放热)。下列说法正确的是( )
2SO3(g) (正反应放热)。下列说法正确的是( )
容器编号 | 容器类型 | 初始体积 | 起始物质的量/mol | 平衡时SO3物质的量/mol | ||
SO2 | O2 | SO3 | ||||
I | 恒温恒容 | 1.0 L | 2 | 1 | 0 | 1.6 |
II | 绝热恒容 | 1.0 L | 2 | 1 | 0 | a |
III | 恒温恒压 | 0.5 L | 0 | 0 | 1 | b |
A.a>1.6
B.b<0.8
C.平衡时v正(SO2):v(I)<v(II)
D.若起始时向容器I中充入1.0 mol SO2(g)、0.20 mol O2(g)和4.0 mol SO3(g),则反应将向正反应方向进行