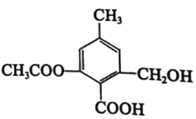
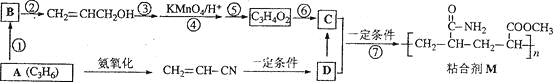
题目内容
【题目】压缩天然气汽车以天然气代替汽车用油,具有价格低、污染少、安全等优点。未经处理的天然气含有H2S,直接使用会造成大气污染,T.F菌在酸性溶液中可实现天然气的催化脱硫,其原理如图所示。下列说法错误的是( )
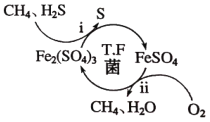
A.Fe2(SO4)3可以视为该脱硫过程中的催化剂
B.该脱硫过程的总反应为:2H2S+O2=2S+2H2O
C.该脱硫过程不能在高温下进行
D.该脱硫过程是将H2S转化为FeSO4
【答案】D
【解析】
天然气中的脱硫原理是:Fe2(SO4)3氧化硫化氢,自身被还原成硫酸亚铁,硫酸亚铁被氧气氧化成硫酸铁,由此分析;
A.T.F菌在酸性溶液中可实现天然气的催化脱硫,Fe2(SO4)3氧化硫化氢,自身被还原成硫酸亚铁,硫酸亚铁被氧气氧化成硫酸铁,Fe2(SO4)3在整个过程中质量和化学性质不变,可以视为催化剂,故A正确;
B.脱硫过程:Fe2(SO4)3氧化硫化氢,自身被还原成硫酸亚铁,硫酸亚铁被氧气氧化成硫酸铁,Fe2(SO4)3视为催化剂,因此脱硫过程O2间接氧化H2S,总反应为:2H2S+O2=2S+2H2O,故B正确;
C.T.F菌的主要成分为蛋白质,高温下蛋白质会发生变性,因此该脱硫过程不能在高温下进行,故C正确;
D.T.F菌在酸性溶液中可实现天然气的催化脱硫,根据图示,Fe2(SO4)3氧化硫化氢生成硫,自身被还原成硫酸亚铁,硫酸亚铁被氧气氧化成硫酸铁,故D错误;
答案选D。

 全能测控期末小状元系列答案
全能测控期末小状元系列答案【题目】氮的氧化物和氮的氢化物的任意排放均会对环境造成污染,因此关于其转化的研究对于消除环境污染有着重要意义。
(1)已知T℃时,有如下反应:
反应I:4NH3(g) + 6NO(g)![]() 5N2 ( g) + 6H2O(g) △H = -1804 kJmol-1
5N2 ( g) + 6H2O(g) △H = -1804 kJmol-1
反应II:N2(g) +2O2(g) ![]() 2NO2(g) △H = +67.8 kJmol-1
2NO2(g) △H = +67.8 kJmol-1
反应III:2NO(g) + O2 (g) ![]() 2 NO2 (g) △H =-116.2 kJmol-1
2 NO2 (g) △H =-116.2 kJmol-1
试写出T℃ 时,NH3与NO2反应生成不污染环境的物质的热化学反应方程式 ______。
(2)T℃时,向2L密闭容器中加入一定量的NO2、NO和O2,发生(1)中反应III,不同时间测得各物质的部分浓度(molL-1) 如下表所示:
时间( min) | NO | O2 | NO2 |
0 | a | 0.30 | 0.10 |
10 | 0.14 | 0.27 | b |
20 | 0.10 | c | 0.20 |
30 | d | 0.24 | 0.22 |
40 | 0.08 | e | f |
①温度不变,反应达平衡后容器中的压强与最初加入气体时的压强之比为_______。
②反应的前 20 min 的平均反应速率v(NO)=________molL-1·min-1。
③若温度不变,平衡后将反应容器压缩为1L,达到新的平衡后,c(O2)_____0.48molL-1(填“>”“<”或“ =”)。
(3)某化学兴趣小组利用电解原理设计实验消除NH3 与 NO对环境的影响, 并制取KOH溶液和H2SO4溶液,其工作原理如下图所示:
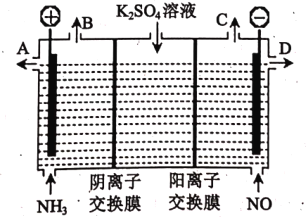
①从出口B、C产生的气体相同,该气体是_____:从出口 D 得到的溶液是____。
②电解槽左池中发生的电极反应式为________ 。
③电解一段时间,两电极共收集到22.4L气体(标准状况下)时,理论上将生成____________mol KOH。