题目内容
9.下列实验操作能达到目的是( )| A. | 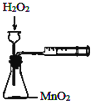 定量测定化学反应速率 | B. | 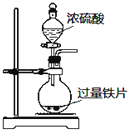 完成铁片与浓硫酸的反应 | ||
| C. |  从食盐水中提取NaCl | D. | 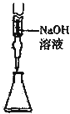 量取15.00mLNaOH |
分析 A.需要时间计算反应速率,且生成的气体可能从长颈漏斗逸出;
B.常温下,Fe遇浓硫酸发生钝化;
C.从食盐水中提取NaCl,选蒸发装置;
D.碱式滴定管可准确量取碱液的体积.
解答 解:A.需要时间计算反应速率,且生成的气体可能从长颈漏斗逸出,图中装置缺少秒表,不能定量测定反应速率,故A错误;
B.常温下,Fe遇浓硫酸发生钝化,阻止反应的进一步发生,则不能完成Fe与浓硫酸的反应,故B错误;
C.从食盐水中提取NaCl,选蒸发装置,需要蒸发皿等,而不能利用坩埚,故C错误;
D.图中为碱式滴定管,碱式滴定管可取15.00mLNaOH,故D正确;
故选D.
点评 本题考查化学实验方案的评价,为高频考点,涉及反应速率测定、物质的性质、蒸发及滴定管使用等,把握物质的性质、反应原理、实验装置的作用为解答的关键,侧重分析与实验能力的考查,题目难度不大,选项B为易错点.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
2.化学与日常生活密切相关,下列说法正确的是( )
| A. | 磨豆浆的大豆富含蛋白质,豆浆煮沸后蛋白质变成了氨基酸 | |
| B. | 做衣服的棉和麻均与淀粉互为同分异构体 | |
| C. | 煎炸食物的花生油和牛油都是可皂化的饱和酯类 | |
| D. | 装饰材料释放的甲醛会造成污染 |
20.下列解释事实的方程式不准确的是( )
| A. | 加热可增强纯碱溶液去污力:CO32-+2H2O?H2CO3+2OH- | |
| B. | 用铁粉与高温水蒸气反应制取磁性氧化铁3Fe+4H2O$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2 | |
| C. | 用烧碱溶液清洗铝表面的氧化膜:2OH-+Al2O3=2AlO2-+H2O | |
| D. | 用稀硝酸洗涤做过银镜反应的试管:3Ag+4H++NO3-=3Ag++NO↑++2H2O |
17.C、Si、S都是重要的非金属元素,以下说法正确的是( )
| A. | 三者的氧化物均为酸性氧化物 | |
| B. | 三者的单质均存在同素异形现象 | |
| C. | CO2、SiO2、SO3都能与H2O反应,其反应类型相同 | |
| D. | 25℃时,物质的量浓度相同的三溶液的pH:Na2SiO3<Na2SO3<Na2CO3 |
4.下列实验现象所对应的离子方程式不正确的是( )
| 实验 | 现象 | 离子方程式 | |
| A |  | 在空气中放置一段时间后,溶液呈蓝色 | 4H++4I-+O2=2I2+2H2O |
| B | 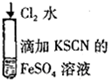 | 溶液由浅绿色变为红色 | 2Fe2++Cl2=2Fe3++2Cl- Fe3++3SCN-=Fe(SCN)3 |
| C |  | 溶液由黄绿色变为无色 | Cl2+2OH-=Cl-+ClO-+H2O |
| D |  | 有白色沉淀生成,溶液由红色变为无色 | Ba2++OH-+H++SO42-=BaSO4+H2O |
| A. | A | B. | B | C. | C | D. | D |
18.几种短周期元素的原子半径及主要化合价如表所示:
下列叙述正确的是( )
| 元素代号 | X | Y | Z | W |
| 原子半径/pm | 160 | 143 | 70 | 66 |
| 主要化合价 | +2 | +3 | +5.+3.-3 | -2 |
| A. | X.Y元素的金属性:X<Y | |
| B. | 一定条件下,Z单质与W的常见单质直接生成ZW2 | |
| C. | 一定条件下,W单质可以将Z单质从其氢化物中置换出来 | |
| D. | Y的最高价氧化物对应的水化物能溶于稀氨水 |
 ;取0.2mol/L的NaOH溶液与0.1mol/L的G溶液等体积混合后,加热至充分反应后,待恢复至室温,剩余溶液中离子浓度由大到小的顺序是c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+),此时测得溶液的pH=12,则此条件下G中阴离子的电离平衡常数Ka=4×10-12
;取0.2mol/L的NaOH溶液与0.1mol/L的G溶液等体积混合后,加热至充分反应后,待恢复至室温,剩余溶液中离子浓度由大到小的顺序是c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+),此时测得溶液的pH=12,则此条件下G中阴离子的电离平衡常数Ka=4×10-12 铁及其化合物在有机化学中应用广泛,例如有机合成中,常用铁和盐酸将硝基(-NO2)还原为氨基(-NH2);在苯的溴代反应中用溴化铁作催化剂.
铁及其化合物在有机化学中应用广泛,例如有机合成中,常用铁和盐酸将硝基(-NO2)还原为氨基(-NH2);在苯的溴代反应中用溴化铁作催化剂. .Fe基态原子核外电子排布式为[Ar]3d64s2.
.Fe基态原子核外电子排布式为[Ar]3d64s2.