题目内容
18.几种短周期元素的原子半径及主要化合价如表所示:| 元素代号 | X | Y | Z | W |
| 原子半径/pm | 160 | 143 | 70 | 66 |
| 主要化合价 | +2 | +3 | +5.+3.-3 | -2 |
| A. | X.Y元素的金属性:X<Y | |
| B. | 一定条件下,Z单质与W的常见单质直接生成ZW2 | |
| C. | 一定条件下,W单质可以将Z单质从其氢化物中置换出来 | |
| D. | Y的最高价氧化物对应的水化物能溶于稀氨水 |
分析 X、Y化合价分别为+2、+3,分别处于ⅡA、ⅢA族,W有-2价,处于ⅥA族,原子半径与X、Y相差较大,可知W处于第二周期,X、Y处于第三周期,故X为Mg、Y为Al、W为O,Z有+5、-3价,处于ⅤA族,原子半径与W形成不大,二者应同周期,故Z为N元素,据此解答.
解答 解:X、Y化合价分别为+2、+3,分别处于ⅡA、ⅢA族,W有-2价,处于ⅥA族,原子半径与X、Y相差较大,可知W处于第二周期,X、Y处于第三周期,故X为Mg、Y为Al、W为O,Z有+5、-3价,处于ⅤA族,原子半径与W形成不大,二者应同周期,故Z为N元素.
A.同周期自左而右金属性减弱,故金属性X(Mg)>Y(Al),故A错误;
B.氮气与氧气在放电或高温条件下反应生成NO,不能直接得到NO2,故B错误;
C.非金属性W(O)>Z(N),氧气氧化性强于氮气,一定条件下,氧气可以与氨气反应生成氮气与水,故C正确;
D.Y的最高价氧化物对应的水化物为氢氧化铝,是两性氢氧化物,能溶于强酸、强碱,不能溶于弱碱氨水,故D错误,
故选C.
点评 本题考查结构性质位置关系应用,根据化合价与原子半径推断元素是解题关键,注意对元素周期律的掌握,难度中等.

练习册系列答案
 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案
相关题目
8.对羟基扁桃酸是合成香料的重要中间体,它可由如下反应制得:
 +
+ $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$
下列说法中,不正确的是( )
 +
+ $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$
下列说法中,不正确的是( )
| A. | 上述反应的原子利用率是100% | |
| B. | 对羟基扁桃酸的核磁共振氢谱有6个吸收峰 | |
| C. | 对羟基扁桃酸可以发生加成反应、取代反应、消去反应和缩聚反应 | |
| D. | 1 mol对羟基扁桃酸与足量NaOH溶液反应,消耗3 mol NaOH |
9.下列实验操作能达到目的是( )
| A. | 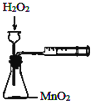 定量测定化学反应速率 | B. | 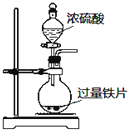 完成铁片与浓硫酸的反应 | ||
| C. |  从食盐水中提取NaCl | D. | 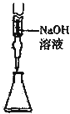 量取15.00mLNaOH |
6.下列关于短周期元素单质间的置换反应的判断错误的是( )
| A. | 金属单质可置换出非金属单质 | B. | 单质所属元素不一定是同主族元素 | ||
| C. | 单质可同为气态,也可同为固态 | D. | 均可在常温下进行反应 |
13.下列物质不能代替H2O2将I-氧化成碘单质的是( )
| A. | 酸性KMnO4溶液 | B. | 新制氯水 | C. | 稀硫酸 | D. | 过氧化钠 |
3.设NA为阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 28 g由C2H4和C3H6组成的混合物中含有氢原子的数目为4 NA | |
| B. | l mol Fe(NO3)3与足量HI溶液反应时转移的电子数为3NA | |
| C. | 1 mol Na2O2固体中含离子总数为4NA | |
| D. | 在标准状况下,11.2L NO2所含电子数为11.5NA |
4.下列球棍模型表示的是各烷烃分子,一氯化物只有一种的是( )
| A. |  | B. |  | C. |  | D. |  |
