题目内容
6.下列解释实验事实的方程式正确的是( )| A. | 常温下反应4Fe(OH)2(s)+2H2O(l)+O2(g)═4Fe(OH)3(s)的△H>0,△S<0 | |
| B. | 500℃、30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭容器中充分反应,放热19.3 kJ,其热化学方程式为:N2(g)+3H2(g)$?_{500℃、30MPa}^{催化剂}$2NH3(g),△H=-38.6 kJ•mol-1 | |
| C. | FeCl3溶液中通入SO2,溶液黄色褪去:2Fe3++SO2+2H2O═2Fe2++SO42-+4H+ | |
| D. | 向苯酚钠溶液中通入CO2,溶液变浑浊:2C6H5O-+CO2+H2O-→2C6H5OH↓+CO32- |
分析 A.该反应能自发进行,且△S<0,应满足△H-T•△S<0,以此进行判断;
B.0.5molN2和1.5molH2置于密闭容器中充分反应生成NH3(g),放热19.3kJ,生成的氨气的物质的量小于1mol,相同条件下的同一可逆反应,正逆反应反应热数值相等,符合相反;
C.三价铁离子能够氧化二氧化硫生成硫酸根离子;
D.不符合反应客观事实,应生成苯酚和碳酸氢钠.
解答 解:A.常温下,反应4Fe(OH)2(s)+2H2O(l)+O2(g)=4Fe(OH)3(s)能自发进行,应满足△H-T•△S<0,该反应为熵减反应,即△S<0,说明是放热反应,△H<0,故A错误;
B.相同条件下的同一可逆反应,正逆反应反应热数值相等,符合相反,0.5molN2和1.5molH2置于密闭容器中充分反应生成NH3(g),放热19.3kJ,生成的氨气的物质的量小于1mol,所以2mol氨气分解,吸收的热量大于38.6kJ,故B错误;
C.FeCl3溶液中通入SO2,溶液黄色褪去,离子方程式:2Fe3++SO2+2H2O═2Fe2++SO42-+4H+,故C正确;
D.向苯酚钠溶液中通入CO2,溶液变浑浊,离子方程式:C6H5O-+CO2+H2O-→C6H5OH↓+HCO3-,故D错误;
故选:C.
点评 本题考查了热化学方程式、离子方程式的书写,明确可逆反应的特点是解题关键,选项B为易错选项.

练习册系列答案
相关题目
14.下列说法正确的是( )
| A. | 丙烯分子中有7个σ键,2个π键 | |
| B. | 在60 g SiO2晶体中,Si-O键的数目为2NA | |
| C. | 共价键有方向性,但无饱和性 | |
| D. | 由ⅠA族和ⅥA族元素形成的原子个数比为1:1、电子总数为38的化合物,是含有共价键的离子化合物 |
11.下列各项正确的是( )
| 电极反应式 | 出现环境 | |
| A | O2+2H2O+4e-═4OH- | 碱性环境下氢氧燃料电池的负极反应 |
| B | 4OH--4e-═2H2O+O2↑ | 弱酸性环境下钢铁的吸氧腐蚀 |
| C | 2H++2e-═H2↑ | 用惰性电极电解NaOH溶液的阴极反应 |
| D | H2-2e-═2H+ | 用惰性电极电解H2SO4的阳极反应 |
| A. | A | B. | B | C. | C | D. | D |
18.如图为短周期的一部分,推断关于Y、Z、M的说法正确的是( )
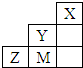
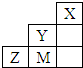
| A. | 非金属性:Y>M>Z | |
| B. | Y、Z、M的氢化物分子各原子最外层均满足8e-稳定结构 | |
| C. | 原子半径:M>Z>Y | |
| D. | Y 的最高价氧化物的水化物的化学式为HYO4 |
15.用下列实验装置完成对应的实验,操作正确并能达到实验目的是( )
| A. |  干燥氯气 | B. |  检验K2CO3中的K+ | ||
| C. |  收集纯净的NH3并验满 | D. |  制备Fe(OH)2 |


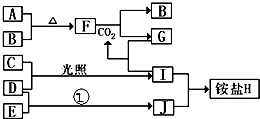 如图是部分短周期元素的单质及其化合物(或其溶液)的转化关系,已知B、C、D、E是非金属单质且在常温常压下都是气体;化合物G的焰色反应为黄色,化合物I和J通常状况下呈气态;反应①是化工生产中的一种固氮反应.
如图是部分短周期元素的单质及其化合物(或其溶液)的转化关系,已知B、C、D、E是非金属单质且在常温常压下都是气体;化合物G的焰色反应为黄色,化合物I和J通常状况下呈气态;反应①是化工生产中的一种固氮反应. .
. 2NH3的化学方程式.
2NH3的化学方程式.