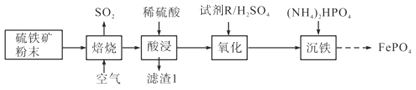
题目内容
【题目】根据下列图示所得出的结论不正确的是

A.图甲是常温下用 0.1000 mol·L-1 NaOH 溶液滴定 20.00mL 0.1000 mol·L-1 CH3COOH 的滴定曲线,说明 Q 点表示酸碱中和滴定终点
B.图乙是 1mol X2(g)、1mol Y2(g)反应生成 2mol XY(g)的能量变化曲线,说明反应物所含化学键的键能总和大于生成物所含化学键的键能总和
C.图丙是恒温密闭容器中发生CaCO3(s) CaO(s)+CO2(g)反应时c(CO2)随反应时间变化的曲线,说明t1时刻改变的条件可能是缩小容器的体积
D.图丁是光照盛有少量氯水的恒容密闭容器时容器内O2的体积分数变化曲线,说明光照 氯水有O2生成
【答案】A
【解析】
A.用0.1000mol/L NaOH溶液滴定20.000mL0.1000mol/LCH3COOH,滴定终点时生成CH3COONa,溶液呈碱性,而Q点溶液的pH=7,呈中性,所以Q点不是滴定终点,故A错误;
B.根据图示可知,该反应为吸热反应,说明反应物所含化学键的键能总和大于生成物所含化学键的键能总和,故B正确;
C.CaCO3(s)=CaO(s)+CO2(g)的平衡常数K=c(CO2),所以温度不变时增大压强重新平衡时二氧化碳浓度不变,根据图示可知,t1时改变条件后CO2的浓度瞬间增大,重新平衡时CO2浓度与原平衡相等,所以t1时刻改变的条件可能是缩小容器的体积,故C正确;
D.光照盛有少量氯水的恒容密闭容器时发生反应:Cl2+H2OHCl+HClO、2HClO![]() 2HCl+O2↑,图示中随着时间的增加,容器内O2的体积分数逐渐增大,能够说明光照氯水放出O2,故D正确;
2HCl+O2↑,图示中随着时间的增加,容器内O2的体积分数逐渐增大,能够说明光照氯水放出O2,故D正确;
故选:A。

【题目】下列对一些实验事实的理论解释正确的是( )
选项 | 实验事实 | 理论解释 |
A | 氮原子的第一电离能大于氧原子 | 氮原子2p能级半充满 |
B | SO2为V形分子 | SO2分子中S原子采用sp3杂化 |
C | 金刚石的熔点低于石墨 | 金刚石是分子晶体,石墨是原子晶体 |
D | HF的沸点高于HCl | HF的相对分子质量小于HCl |
A. AB. BC. CD. D