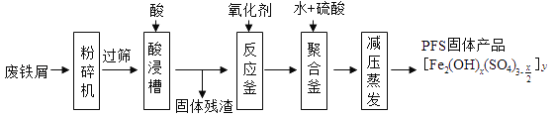
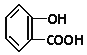
题目内容
【题目】已知:还原性HSO—3>I—,氧化性IO—3>I2。在含0.3mol NaHSO3的溶液中逐滴加入KIO3溶液。加入KIO3和析出I2的物质的量的关系曲线如右图所示。下列说法不正确的是
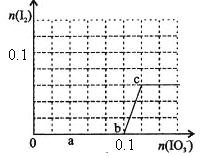
A.0~b间的反应可用如下离子方程式表示:3HSO3-+IO3-=3SO42-+I-+3H+
B.a点时消耗NaHSO3的物质的量为0.12mol
C.当溶液中I—与I2的物质的量之比为5:2时,加入的KIO3为0.18mol
D.b点时的还原产物可能是KI或NaI,b~c间的还原产物是I2
【答案】C
【解析】
试题还原性HSO-3>I-,所以首先发生的离子反应是3HSO3-+IO3-=3SO42-+I-+3H+。继续加入KIO3,已知氧化性IO-3>I2,所以IO3-可以结合H+氧化I-生成I2,离子方程式是IO3-+6H++5I-=3H2O+3I2,根据发生的反应,则:A、根据图像可知,0~b间没有单质碘生成,所以反应可用如下离子方程式表示:3HSO3-+IO3-=3SO42-+I-+3H+,A正确;B、根据图像可知,a点碘酸钾的物质的量是0.04mol,所以根据反应3HSO3-+IO3-=3SO42-+I-+3H+可知,消耗NaHSO3的物质的量为0.04mol×3=0.12mol,B正确;C、设生成的碘单质的物质的量为n,则溶液中I—的物质的量是2.5n。则根据反应IO3-+6H++5I-=3H2O+3I2可知,消耗的KIO3的物质的量为![]() ,消耗碘离子的量为
,消耗碘离子的量为![]() 。根据反应3HSO3-+IO3-=3SO42-+I-+3H+可知,0.3molNaHSO3的溶液消耗KIO3溶液的物质的量为0.1mol,生成碘离子的物质的量也是0.1mol,则0.1mol-
。根据反应3HSO3-+IO3-=3SO42-+I-+3H+可知,0.3molNaHSO3的溶液消耗KIO3溶液的物质的量为0.1mol,生成碘离子的物质的量也是0.1mol,则0.1mol-![]() =2.5n,解得
=2.5n,解得![]() =
=![]() mol,所以消耗碘酸钾的物质的量是(
mol,所以消耗碘酸钾的物质的量是(![]() +0.1mol)=0.108mol,C不正确;D、根据以上分析可知,b点时的还原产物可能是KI或NaI,b~c间的还原产物是I2,D正确,答案选C。
+0.1mol)=0.108mol,C不正确;D、根据以上分析可知,b点时的还原产物可能是KI或NaI,b~c间的还原产物是I2,D正确,答案选C。

 名校课堂系列答案
名校课堂系列答案【题目】乙酸是生物油的主要成分之一,乙酸制氢具有重要意义:
反应I(热裂解):CH3COOH(g)2CO(g)+2H2(g) △H1
反应II(脱羧基):CH3COOH(g)CH4(g)+CO2(g) △H2
已知:反应I的活化能为(E5-E2)kJ,反应I逆反应的活化能为(E5-E3)kJ,反应II的活化能为(E4-E2)kJ,反应II逆反应的活化能为(E4-E1)kJ,E1到E5能量依次增大
(1)△H1+△H2=___________kJ/mol (用有关E的代数式表示);
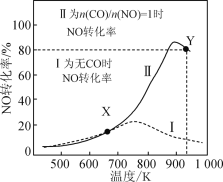
(2)在不同温度下,向密闭容器中充入等量醋酸蒸汽,反应相同时间后,测得各气体的产率与温度的关系如图所示:

①约650℃之前,氢气产率低于甲烷的原因是;________________________________;
②约650℃之后,随着温度升高后,氢气产率高于甲烷的原因是:___________;(填编号)
a. 反应II速率减慢
b. 反应I速率加快的程度比反应II大
c. 反应I正向移动,而反应II逆向移动
d. 反应I正向移动的程度大于反应II正向移动的程度
③根据图像分析,该容器中一定发生了另外的副反应,理由是:______________。
(3)投入一定量的乙酸,在相同压强下,经过相同反应时间测得如下实验数据:
温度(℃) | 催化剂 | CH3COOH转化率 | H2的选择性 |
550 | 甲 | 14.5 | 40.2 |
550 | 乙 | 11.1 | 62.1 |
600 | 甲 | 11.2 | 41.2 |
600 | 乙 | 10.3 | 63.3 |
(H2的选择性:转化的CH3COOH中生成H2的百分比)
①表中实验数据表明,在相同温度下不同的催化剂对CH3COOH转化成H2的选择性有显著的影响,其原因是________。
②有利于提高CH3COOH转化为H2平衡转化率的措施有________。
A.使用催化剂甲 B.使用催化剂乙
C.升高反应温度 D.增加反应物的浓度
【题目】I.《自然》杂志曾报道我国科学家通过测量SiO2中26Al和10Be两种元素的比例确定“北京人”年龄的研究结果,这种测量方法叫“铝铍测年法”。完成下列填空:
(1)l0Be和9Be_____________(填序号)。
a.是同一种原子 b.具有相同的中子数 c.具有相同的化学性质 d.互为同位素
(2)写出A1(OH)3与NaOH溶液反应的化学方程式:_________________________。
(3)研究表明28A1可以衰变为26Mg,可以比较这两种元素金属性强弱的方法是____________(填序号)。
a.比较Mg(OH)2与A1(OH)3的碱性强弱
b.比较这两种元素的最高正化合价
c.将打磨过表面积相同的镁条和铝片分别和100℃热水作用,并滴入酚酞溶液
d.比较这两种金属的硬度和熔点
II.下表列出了①~⑩10种元素在周期表中的位置。
周期 族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ⑤ | ⑥ | ⑩ | |||||
3 | ① | ③ | ④ | ⑦ | ⑧ | |||
4 | ② | ⑨ |
(1)上述元素中,金属性最强的是(填元素符号,下同)________,③④⑤三种元素的原子半径由大到小的顺序是____________。
(2)上述元素的最高价氧化物对应的水化物中酸性最强的是________(填化学式)
(3)元素⑥的氢化物的电子式为____________,该氢化物与元素⑥的最高价氧化物对应的水化物反应的化学方程式为_______________________________________。