题目内容
【题目】氢气在氧气中燃烧产生淡蓝色火焰。在反应过程中,破坏1 mol氢气中的化学键消耗的能量为Q1kJ,破坏1 mol氧气中的化学键消耗的能量为Q2KJ,形成1 mol水中的化学键释放的能量为Q3kJ。下列关系式中正确的是
A.2Q1+Q2 <2Q3B.Q1+Q2>Q3C.Q1+Q2< Q3D.Q1+Q2> 2Q3
【答案】A
【解析】
破坏1molH2中的化学键消耗的能量为Q1kJ,则H-H键能为Q1kJ/mol,破坏1molO2中的化学键消耗的能量为Q2kJ,则O=O键能为Q2kJ/mol,形成1mol水中的化学键释放的能量为Q3kJ,则水分子中2个H-O键能和为Q3kJ/mol,对于2H2(g)+O2(g)═2H2O(g),反应热△H=反应物的总键能-生成物的总键能,故:反应热△H=2Q1kJ/mol+Q2kJ/mol-4×![]() Q3kJ/mol=2Q1kJ/mol+Q2kJ/mol-2Q3kJ/mol=(2Q1+Q2-2Q3)kJ/mol,由于氢气在氧气中燃烧是放热反应,则2Q1+Q2-2Q3<0,所以2Q1+Q2<2Q3,选A。
Q3kJ/mol=2Q1kJ/mol+Q2kJ/mol-2Q3kJ/mol=(2Q1+Q2-2Q3)kJ/mol,由于氢气在氧气中燃烧是放热反应,则2Q1+Q2-2Q3<0,所以2Q1+Q2<2Q3,选A。

练习册系列答案
 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案
相关题目
【题目】下列实验装置示意图、实验现象及结论均正确的是( )
A | B | C | D | |
实验 |
|
|
|
|
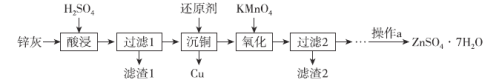
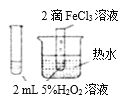
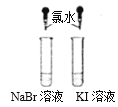
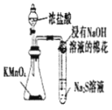
现象 | 产生能使带火星小木条复燃的气体 | 两试管中均颜色变化 | 试管中有淡黄色沉淀产生 | 钠表面有气泡生成 |
结论 | FeCl3是H2O2分解的催化剂 | 单质氧化性:Cl2>Br2>I2 | 非金属性Cl>S | 1 mol乙醇与足量钠反应生成3 mol氢气 |
A.AB.BC.CD.D