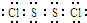题目内容
19.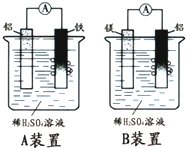 有甲、乙两位学生分别利用如图A、B装置的原电池反应检测金属的活动性顺序,
有甲、乙两位学生分别利用如图A、B装置的原电池反应检测金属的活动性顺序,(1)A装置中,正极是铁极,负极是铝极,B装置中,正极是铝极,负极是镁极,
(2)A装置中正极的电极反应式:2H++2e-=H2;
A装置中总反应的反应方程式:2Al+6H+=2Al3++3H2.
(3)B装置中负极的电极反应式:Mg-2e-=Mg2+;
B装置中总反应的反应方程式:Mg+2H+=Mg2++H2.
(4)由此实验,可得到关于三种金属的活动性强弱的顺是:Mg>Al>Fe.
分析 A装置中,铝比铁活泼,所以正极是铁得电子发生还原反应,反应式为2H++2e-=H2,负极是铝失电子发生氧化反应,反应式为Al-3e-=Al3+,B装置中,镁比铝活泼,所以正极是铝,得电子发生还原反应,反应式为2H++2e-=H2,负极是镁失电子发生氧化反应,反应式为Mg-2e-=Mg2+,据此分析解答.
解答 解:(1)A装置中,铝比铁活泼,所以正极是铁,负极是铝;B装置中,镁比铝活泼,所以正极是铝,负极是镁;故答案为:铁、铝;铝、镁;
(2)A装置中,铝比铁活泼,所以正极是铁得电子发生还原反应,反应式为2H++2e-=H2,负极是铝失电子发生氧化反应,反应式为Al-3e-=Al3+,总反应为:
2Al+6H+=2Al3++3H2,故答案为:2H++2e-=H2;2Al+6H+=2Al3++3H2;
(3)B装置中,镁比铝活泼,所以正极是铝,得电子发生还原反应,反应式为2H++2e-=H2,负极是镁失电子发生氧化反应,反应式为Mg-2e-=Mg2+,总反应为:
Mg+2H+=Mg2++H2,故答案为:Mg-2e-=Mg2+;Mg+2H+=Mg2++H2;
(4)由此实验,可得到关于三种金属的活动性强弱的顺是Mg>Al>Fe,故答案为:Mg>Al>Fe.
点评 本题考查了原电池原理,明确正负极的判断、电极上的反应等知识点即可解答,注意较活泼的金属一般作负极,难度不大.

练习册系列答案
相关题目
9.Ⅰ、下表所列物质(括号内为少量杂质),在B中选择试剂,在C中选择操作的方法.填表(填入序号):
B:(1)NaCl细颗粒;(2)NaOH溶液;(3)水;(4)CaO;(5)饱和Na2CO3;(6)溴水;(7)KMnO4溶液.
C:(1)变性;(2)盐析;(3)蒸馏;(4)分液;(5)结晶;(6)洗气.
Ⅱ、1mol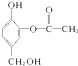 与足量的NaOH溶液充分反应,消耗NaOH的物质的量为3mol.
与足量的NaOH溶液充分反应,消耗NaOH的物质的量为3mol.
B:(1)NaCl细颗粒;(2)NaOH溶液;(3)水;(4)CaO;(5)饱和Na2CO3;(6)溴水;(7)KMnO4溶液.
C:(1)变性;(2)盐析;(3)蒸馏;(4)分液;(5)结晶;(6)洗气.
| 物质 | 加入试剂 | 操作方法 |
| ①苯(苯甲酸) | (2) | (4) |
| ②乙酸乙酯(乙醇) | (5) | (4) |
 与足量的NaOH溶液充分反应,消耗NaOH的物质的量为3mol.
与足量的NaOH溶液充分反应,消耗NaOH的物质的量为3mol.
7.下列粒子在相应的分散系中能大量共存的是( )
| A. | 氢氧化钠溶液:K+、SO32-、CH3COOH、NH3•H2O | |
| B. | 硅酸胶体:H+、K+、SO42-、Br- | |
| C. | 氨水:Na+、Ba2+、Cl-、NO3- | |
| D. | 高锰酸钾溶液:H+、Na+、SO42-、H2O2 |
14.下列措施对增大反应速率明显有效的是( )
| A. | Al在氧气中燃烧生成A12O3,将Al粉改为Al片 | |
| B. | Fe与稀硫酸反应制取H2时,改用质量分数为98.3%的浓硫酸 | |
| C. | Zn与稀硫酸反应时,适当提高溶液的温度 | |
| D. | Na与水反应时增大水的用量 |
4.下列说法正确的是( )
| A. | 离子化合物中只能含离子键,不能有共价键 | |
| B. | 非金属元素之间形成的化学键一定是共价键 | |
| C. | 电子数相同的两种微粒一定是同一元素 | |
| D. | 化学键被破坏的变化不一定是化学变化 |
8.下列说法中正确的是( )
| A. | C60气化和金刚石熔化克服的作用力相同 | |
| B. | 甲酸甲酯的熔点低于乙酸的熔点 | |
| C. | 氯化钠和氯化氢溶于水时,破坏的化学键都是离子键 | |
| D. | 分子晶体的熔沸点低,常温下均呈液态或气态 |
9.下列元素中不属于主族元素的是( )
| A. | 硒 | B. | 锌 | C. | 硼 | D. | 铋 |