题目内容
8.下列说法中正确的是( )| A. | C60气化和金刚石熔化克服的作用力相同 | |
| B. | 甲酸甲酯的熔点低于乙酸的熔点 | |
| C. | 氯化钠和氯化氢溶于水时,破坏的化学键都是离子键 | |
| D. | 分子晶体的熔沸点低,常温下均呈液态或气态 |
分析 A.C60属于分子晶体,金刚石属于原子晶体;
B.乙酸含有氢键,沸点较高;
C.氯化氢为共价化合物;
D.分子晶体常温下可以固体存在.
解答 解:A.C60属于分子晶体,金刚石属于原子晶体,熔化分别克服分子间作用力、共价键,故A错误;
B.乙酸含有氢键,沸点较高,故B正确;
C.氯化氢为共价化合物,不含离子键,故C错误;
D.分子晶体存在常温下呈固态的物质,例如S、白磷、红磷、C60等都属于分子晶体,在常温下为固态,故D错误.
故选B.
点评 本题考查晶体的类型与性质,综合考查晶体类型和性质,题目难度不大,注意晶体的组成、结构、性质等知识的积累.

练习册系列答案
 应用题作业本系列答案
应用题作业本系列答案
相关题目
18.下列有关实验操作中合理的是( )
| A. | 用托盘天平称取11.70 g食盐 | |
| B. | 用量筒量取12.36 mL盐酸 | |
| C. | 用酸式滴定管量取21.20 mL 0.10 mol•L-1的H2SO4溶液 | |
| D. | 测定溶液的pH时,用洁净、干燥的玻璃棒蘸取溶液,点在用蒸馏水润湿过的pH试纸上,再与标准比色卡比较 |
13.下列叙述错误的是( )
| A. | SO2、SO3都是极性分子 | |
| B. | 元素电负性越大的原子,吸引电子能力越强 | |
| C. | 非极性键可以存在于化合物中 | |
| D. | 离子化合物的熔点不一定比共价化合物的高 |
20.有关如图所示化合物的说法不正确的是( )
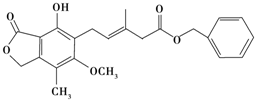

| A. | 该化合物可与NaHCO3溶液反应放出CO2气体 | |
| B. | 1 mol该化合物最多可以与3 mol NaOH反应 | |
| C. | 该化合物可以使酸性KMnO4溶液褪色 | |
| D. | 该化合物可以在光照下与Cl2发生取代反应 |
17.有一混合物的水溶液,可能含有以下离子中的若干种:K+、NH4+、Cl-、Mg2+、Ba2+、CO32-、SO42-,现取三份100mL溶液进行如下实验:
(1)第一份加入AgNO3溶液有沉淀产生
(2)第二份加足量NaOH溶液加热后,收集到气体0.04mol
(3)第三份加足量BaCl2溶液后,得干燥沉淀6.27g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g.
根据上述实验,以下推测正确的是( )
(1)第一份加入AgNO3溶液有沉淀产生
(2)第二份加足量NaOH溶液加热后,收集到气体0.04mol
(3)第三份加足量BaCl2溶液后,得干燥沉淀6.27g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g.
根据上述实验,以下推测正确的是( )
| A. | K+一定存在 | B. | 100mL溶液中含0.01mol CO32- | ||
| C. | Ba2+一定不存在,Mg2+可能存在 | D. | Cl-一定存在 |
18.下列实验操作需要用温度计且不把它插入液体中的是( )
| A. | 乙醇制乙烯 | B. | 硝酸钾溶解度的测定 | ||
| C. | 实验室蒸馏石油 | D. | 煤的干馏 |
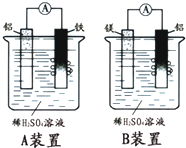 有甲、乙两位学生分别利用如图A、B装置的原电池反应检测金属的活动性顺序,
有甲、乙两位学生分别利用如图A、B装置的原电池反应检测金属的活动性顺序,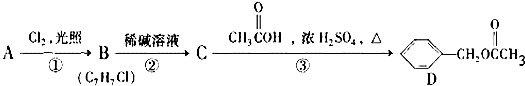
 ,C的名称:苯甲醇.
,C的名称:苯甲醇.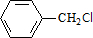 +NaOH$→_{△}^{H_{2}O}$
+NaOH$→_{△}^{H_{2}O}$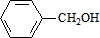 +NaCl.
+NaCl. .
.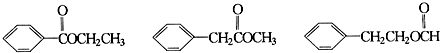 .
.