题目内容
9.Ⅰ、下表所列物质(括号内为少量杂质),在B中选择试剂,在C中选择操作的方法.填表(填入序号):B:(1)NaCl细颗粒;(2)NaOH溶液;(3)水;(4)CaO;(5)饱和Na2CO3;(6)溴水;(7)KMnO4溶液.
C:(1)变性;(2)盐析;(3)蒸馏;(4)分液;(5)结晶;(6)洗气.
| 物质 | 加入试剂 | 操作方法 |
| ①苯(苯甲酸) | (2) | (4) |
| ②乙酸乙酯(乙醇) | (5) | (4) |
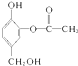 与足量的NaOH溶液充分反应,消耗NaOH的物质的量为3mol.
与足量的NaOH溶液充分反应,消耗NaOH的物质的量为3mol.
分析 Ⅰ.苯甲酸与氢氧化钠溶液发生中和反应生成溶于水的盐;乙醇易溶于水,乙酸乙酯不溶于饱和碳酸钠溶液;
Ⅱ. 中能与氢氧化钠反应的官能团为酚羟基和酯基.
中能与氢氧化钠反应的官能团为酚羟基和酯基.
解答 解:Ⅰ.苯甲酸与氢氧化钠溶液反应生成溶于水的苯甲酸钠,而苯不溶于水,可用分液的方法分离;乙醇易溶于水,乙酸乙酯不溶于饱和碳酸钠溶液,
故答案为:
| 物质 | 加入试剂 | 操作方法 |
| ①苯(苯甲酸) | (2) | (4) |
| ②乙酸乙酯(乙醇) | (5) | (4) |
Ⅱ.
 中能与氢氧化钠反应的官能团为酚羟基和酯基,且酯基可水解少吃酚羟基和羧基,则1mol有机物消耗3mol氢氧化钠,故答案为:3.
中能与氢氧化钠反应的官能团为酚羟基和酯基,且酯基可水解少吃酚羟基和羧基,则1mol有机物消耗3mol氢氧化钠,故答案为:3.点评 本题考查物质分离、提纯的实验方案的设计,为高频考点,把握物质的性质及混合物分离提纯方法为解答的关键,综合考查常见有机物的性质及分离原理,题目难度不大.

练习册系列答案
相关题目
4.A、B、C、D、E五种物质均是由两种离子组成,它们均可溶于水并完全电离,电离出的所有离子如下表所示:
(1)某同学通过比较分析,认为无需检验就可判断出其中必有的两种物质是Na2CO3、Ba(OH)2 (填化学式);若将此两种物质记为A和B,含X的物质记为C,当C的溶液与B的溶液混合时,产生红褐色沉淀和无色无味的气体;当C的溶液与A的溶液混合时也产生沉淀,向该沉淀中滴入过量的稀HNO3时,沉淀部分溶解,但最后留下白色的固
体,则离子X的符号为SO42-.
(2)将0.02mol A与0.O1mol C同时溶解在足量的蒸馏水中,充分反应后最后得到的沉淀质量为6.1g (精确到0.1g).
| 阳离子 | Na+、Al3+、Mg2+、Ba2+、Fe3+ |
| 阴离子 | Cl-、OH-、NO3-、CO32-、X |
体,则离子X的符号为SO42-.
(2)将0.02mol A与0.O1mol C同时溶解在足量的蒸馏水中,充分反应后最后得到的沉淀质量为6.1g (精确到0.1g).
14. 分类方法在化学学科的发展中起了非常重要的作用.如图是某反应在密闭容器中反应前后的分子状况示意图,“
分类方法在化学学科的发展中起了非常重要的作用.如图是某反应在密闭容器中反应前后的分子状况示意图,“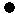 ”和“
”和“ ”分别表示不同的原子.对此反应的分类一定不正确的是( )
”分别表示不同的原子.对此反应的分类一定不正确的是( )
 分类方法在化学学科的发展中起了非常重要的作用.如图是某反应在密闭容器中反应前后的分子状况示意图,“
分类方法在化学学科的发展中起了非常重要的作用.如图是某反应在密闭容器中反应前后的分子状况示意图,“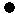 ”和“
”和“ ”分别表示不同的原子.对此反应的分类一定不正确的是( )
”分别表示不同的原子.对此反应的分类一定不正确的是( )| A. | 置换反应 | B. | 氧化还原反应 | C. | 放热反应 | D. | 化合反应 |
1.下列实验操作或描述中错误的是( )
| A. | 将NaNO3和KCl的混合液加热并浓缩至有晶体析出,趁热过滤时,可分离出NaCl晶体 | |
| B. | 溶剂蒸发的速度越快,或浓缩后的溶液冷却得越快,析出的晶体颗粒就越大 | |
| C. | 用倾析法分离时,将烧杯中的上层清液用玻璃棒引流到另一容器内,即可使沉淀与清液分离 | |
| D. | 用移液管取液后,将移液管垂直放入稍倾斜的容器中,并使管尖与容器内壁接触,松开食指使溶液全部流出,数秒后,取出移液管 |
18.下列有关实验操作中合理的是( )
| A. | 用托盘天平称取11.70 g食盐 | |
| B. | 用量筒量取12.36 mL盐酸 | |
| C. | 用酸式滴定管量取21.20 mL 0.10 mol•L-1的H2SO4溶液 | |
| D. | 测定溶液的pH时,用洁净、干燥的玻璃棒蘸取溶液,点在用蒸馏水润湿过的pH试纸上,再与标准比色卡比较 |
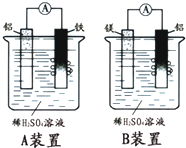 有甲、乙两位学生分别利用如图A、B装置的原电池反应检测金属的活动性顺序,
有甲、乙两位学生分别利用如图A、B装置的原电池反应检测金属的活动性顺序,