题目内容
14.下列措施对增大反应速率明显有效的是( )| A. | Al在氧气中燃烧生成A12O3,将Al粉改为Al片 | |
| B. | Fe与稀硫酸反应制取H2时,改用质量分数为98.3%的浓硫酸 | |
| C. | Zn与稀硫酸反应时,适当提高溶液的温度 | |
| D. | Na与水反应时增大水的用量 |
分析 影响化学反应速率的因素有温度、浓度、压强、催化剂以及固体的接触面积等等,据此分析.
解答 解:A、将Al粉改为Al片,减小了反应物的接触面积,所以能使反应速率减慢,故A错误;
B、Fe与稀硫酸反应制取H2时,改用质量分数为98.3%的浓硫酸,Fe在浓硫酸中钝化,不能生成氢气,故B错误;
C、Zn与稀硫酸反应时,适当提高溶液的温度,升高温度能加快化学反应的速率,故C正确;
D、水的浓度是常数,钠和水反应的速率与水的多少无关,故D错误.
故选C.
点评 本题考查学生影响化学反应速率的因素,可以根据所学知识进行回答,难度不大.

练习册系列答案
相关题目
4.A、B、C、D、E五种物质均是由两种离子组成,它们均可溶于水并完全电离,电离出的所有离子如下表所示:
(1)某同学通过比较分析,认为无需检验就可判断出其中必有的两种物质是Na2CO3、Ba(OH)2 (填化学式);若将此两种物质记为A和B,含X的物质记为C,当C的溶液与B的溶液混合时,产生红褐色沉淀和无色无味的气体;当C的溶液与A的溶液混合时也产生沉淀,向该沉淀中滴入过量的稀HNO3时,沉淀部分溶解,但最后留下白色的固
体,则离子X的符号为SO42-.
(2)将0.02mol A与0.O1mol C同时溶解在足量的蒸馏水中,充分反应后最后得到的沉淀质量为6.1g (精确到0.1g).
| 阳离子 | Na+、Al3+、Mg2+、Ba2+、Fe3+ |
| 阴离子 | Cl-、OH-、NO3-、CO32-、X |
体,则离子X的符号为SO42-.
(2)将0.02mol A与0.O1mol C同时溶解在足量的蒸馏水中,充分反应后最后得到的沉淀质量为6.1g (精确到0.1g).
5.下列物质中不存在氢键的是( )
| A. | 乙醇 | B. | 乙酸 | C. | 苯酚 | D. | 苯 |
2.某CH4燃料电池,工作环境是熔融的金属氧化物(MO),它能传导O2-,有关CH4燃料电池的说法中正确的是( )
| A. | 电池内部电子从正极流向负极 | |
| B. | 负极电极反应式为:CH4-8e-+10OH-═CO32-+7H2O | |
| C. | 正极电极反应式为:O2+4e-═2O2- | |
| D. | 每消耗22.4 L CH4,外线路中将通过8 mol电子 |
9.下列化学用语正确的是( )
| A. | CH4分子的比例模型: | B. | 乙烯的结构简式:CH2CH2 | ||
| C. | 甲醛分子的电子式: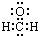 | D. | 基态硫原子的价电子排布:2s22p4 |
6.在一定温度下的恒容密闭容器中,能说明反应X2(g)+Y2(g)?$?_{△}^{浓硫酸}$?2XY(g)已达到平衡的是( )
| A. | 容器内的总压不随时间变化 | |
| B. | 容器中气体的平均相对分子质量不随时间变化 | |
| C. | XY气体的物质的量分数不变 | |
| D. | X2和Y2的消耗速率相等 |
4.利用表中的数据判断,V元素最有可能是下列元素中的( )
| A. | H | B. | Li | C. | Na | D. | K |
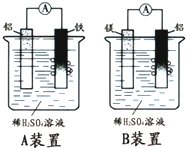 有甲、乙两位学生分别利用如图A、B装置的原电池反应检测金属的活动性顺序,
有甲、乙两位学生分别利用如图A、B装置的原电池反应检测金属的活动性顺序,
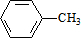 ,C的名称:苯甲醇.
,C的名称:苯甲醇. +NaOH$→_{△}^{H_{2}O}$
+NaOH$→_{△}^{H_{2}O}$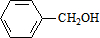 +NaCl.
+NaCl. .
. .
.