题目内容
7.下列粒子在相应的分散系中能大量共存的是( )| A. | 氢氧化钠溶液:K+、SO32-、CH3COOH、NH3•H2O | |
| B. | 硅酸胶体:H+、K+、SO42-、Br- | |
| C. | 氨水:Na+、Ba2+、Cl-、NO3- | |
| D. | 高锰酸钾溶液:H+、Na+、SO42-、H2O2 |
分析 A.醋酸与亚硫酸根离子、一水合氨、强氧化钠溶液反应;
B.硅酸胶体带有负电荷,能够与电解质溶液发生聚沉现象;
C.四种离子之间不反应,都不与氨水反应;
D.酸性条件下高锰酸钾溶液能够氧化双氧水.
解答 解:A.CH3COOH与SO32-、NH3•H2O、NaOH发生反应,在溶液中不能大量共存,故A错误;
B.硅酸胶体带有负电荷,能够与氢离子、钾离子发生聚沉现象,故B错误;
C.Na+、Ba2+、Cl-、NO3-之间不发生反应,都不与氨水反应,在溶液中能够大量共存,故C正确;
D.酸性高锰酸钾溶液具有强氧化性,能够氧化H2O2,在溶液中不能大量共存,故D错误;
故选C.
点评 本题考查离子共存的判断,为高考的高频题,属于中等难度的试题,注意明确离子不能大量共存的一般情况,如:能发生复分解反应的离子之间,能发生氧化还原反应的离子之间等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;D中注意酸性高锰酸根离子能够氧化双氧水.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
18.下列有关实验操作中合理的是( )
| A. | 用托盘天平称取11.70 g食盐 | |
| B. | 用量筒量取12.36 mL盐酸 | |
| C. | 用酸式滴定管量取21.20 mL 0.10 mol•L-1的H2SO4溶液 | |
| D. | 测定溶液的pH时,用洁净、干燥的玻璃棒蘸取溶液,点在用蒸馏水润湿过的pH试纸上,再与标准比色卡比较 |
15.下列对化学反应的认识不正确的是( )
| A. | 化学反应过程中,一定有新物质生成 | |
| B. | 化学反应过程中,一定有化学键的断裂和形成 | |
| C. | 化学反应过程中,一定有能量的变化 | |
| D. | 如果某化学反应的△H和△S均小于0,则该反应一定能自发进行 |
2.某CH4燃料电池,工作环境是熔融的金属氧化物(MO),它能传导O2-,有关CH4燃料电池的说法中正确的是( )
| A. | 电池内部电子从正极流向负极 | |
| B. | 负极电极反应式为:CH4-8e-+10OH-═CO32-+7H2O | |
| C. | 正极电极反应式为:O2+4e-═2O2- | |
| D. | 每消耗22.4 L CH4,外线路中将通过8 mol电子 |
12.下列叙述合理的是( )
| A. | 金属氧化物是碱性氧化物,酸性氧化物都不能与酸反应 | |
| B. | 明矾[KAl(SO4)2•12H2O]在水中能形成Al(OH)3胶体,可用作净水剂 | |
| C. | ClO2气体中氯元素显+4价,具有强氧化性,其消毒效率(单位体积气体得到电子的数目)是Cl2的5倍 | |
| D. | 雷雨过后感觉空气清新是因为在闪电时发生反应:N2+O2$\frac{\underline{\;放电\;}}{\;}$2NO,使空气中含有一定量的NO |
17.有一混合物的水溶液,可能含有以下离子中的若干种:K+、NH4+、Cl-、Mg2+、Ba2+、CO32-、SO42-,现取三份100mL溶液进行如下实验:
(1)第一份加入AgNO3溶液有沉淀产生
(2)第二份加足量NaOH溶液加热后,收集到气体0.04mol
(3)第三份加足量BaCl2溶液后,得干燥沉淀6.27g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g.
根据上述实验,以下推测正确的是( )
(1)第一份加入AgNO3溶液有沉淀产生
(2)第二份加足量NaOH溶液加热后,收集到气体0.04mol
(3)第三份加足量BaCl2溶液后,得干燥沉淀6.27g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g.
根据上述实验,以下推测正确的是( )
| A. | K+一定存在 | B. | 100mL溶液中含0.01mol CO32- | ||
| C. | Ba2+一定不存在,Mg2+可能存在 | D. | Cl-一定存在 |
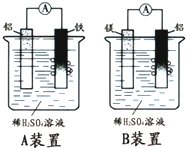 有甲、乙两位学生分别利用如图A、B装置的原电池反应检测金属的活动性顺序,
有甲、乙两位学生分别利用如图A、B装置的原电池反应检测金属的活动性顺序,