题目内容
11.仿照电极方程式的书写,我们可以把一些氧化还原反应分成“氧化反应”和“还原反应”两个“半反应”,如Fe+2H+═Fe2++H2↑可分成氧化反应:Fe-2e-═Fe2+还原反应:2H++2e-=H2↑则下列正确的是( )①Fe+2Fe3+═3Fe2+可分成 氧化反应:Fe-2e-═Fe2+ 还原反应:2Fe3++2e-═2Fe2+
②MnO2+2Cl-+4H+═Mn2++Cl2↑+2H2O 氧化反应:2Cl--2e-═Cl2↑ 还原反应:MnO2+2e-+4H+═Mn2++2H2O
③Cl2+H2S═S↓+2H++2Cl- 氧化反应:H2S-2e-═S↓+2H+ 还原反应:Cl2↑+2e-═2Cl-.
| A. | ③ | B. | ②③ | C. | ①② | D. | ①②③ |
分析 在氧化还原反应中,氧化剂得电子化合价降低发生还原反应,还原剂失电子化合价升高发生氧化反应,据此分析解答.
解答 解:①Fe+2Fe3+═3Fe2+中Fe失电子发生氧化反应、铁离子得电子发生还原反应,所以发生氧化反应Fe-2e-═Fe2+、还原反应2Fe3++2e-═2Fe2+,故正确;
②MnO2+2Cl-+4H+=Mn2++Cl2↑+2H2O中Mn元素化合价由+4价变为+2价、Cl元素化合价由-1价变为0价,所以发生氧化反应2Cl--2e-═Cl2↑、还原反应MnO2+2e-+4H+═Mn2++2H2O,故正确;
③Cl2+H2S═S↓+2H++2Cl-中Cl元素化合价由0价变为-1价、S元素化合价由-2价变为0价,所以发生氧化反应H2S-2e-═S↓+2H+、还原反应Cl2+2e-═2Cl-,故正确;
故选D.
点评 本题考查了氧化还原反应,根据元素化合价变化利用知识迁移方法书写氧化反应和还原反应,其总反应为氧化还原反应,与电极反应式类似,题目难度不大.

练习册系列答案
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案
相关题目
1.下列实验操作或描述中错误的是( )
| A. | 将NaNO3和KCl的混合液加热并浓缩至有晶体析出,趁热过滤时,可分离出NaCl晶体 | |
| B. | 溶剂蒸发的速度越快,或浓缩后的溶液冷却得越快,析出的晶体颗粒就越大 | |
| C. | 用倾析法分离时,将烧杯中的上层清液用玻璃棒引流到另一容器内,即可使沉淀与清液分离 | |
| D. | 用移液管取液后,将移液管垂直放入稍倾斜的容器中,并使管尖与容器内壁接触,松开食指使溶液全部流出,数秒后,取出移液管 |
2.某CH4燃料电池,工作环境是熔融的金属氧化物(MO),它能传导O2-,有关CH4燃料电池的说法中正确的是( )
| A. | 电池内部电子从正极流向负极 | |
| B. | 负极电极反应式为:CH4-8e-+10OH-═CO32-+7H2O | |
| C. | 正极电极反应式为:O2+4e-═2O2- | |
| D. | 每消耗22.4 L CH4,外线路中将通过8 mol电子 |
6.在一定温度下的恒容密闭容器中,能说明反应X2(g)+Y2(g)?$?_{△}^{浓硫酸}$?2XY(g)已达到平衡的是( )
| A. | 容器内的总压不随时间变化 | |
| B. | 容器中气体的平均相对分子质量不随时间变化 | |
| C. | XY气体的物质的量分数不变 | |
| D. | X2和Y2的消耗速率相等 |
20.有关如图所示化合物的说法不正确的是( )
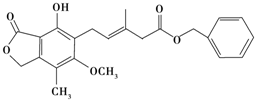

| A. | 该化合物可与NaHCO3溶液反应放出CO2气体 | |
| B. | 1 mol该化合物最多可以与3 mol NaOH反应 | |
| C. | 该化合物可以使酸性KMnO4溶液褪色 | |
| D. | 该化合物可以在光照下与Cl2发生取代反应 |
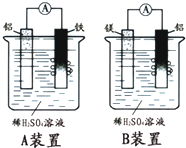 有甲、乙两位学生分别利用如图A、B装置的原电池反应检测金属的活动性顺序,
有甲、乙两位学生分别利用如图A、B装置的原电池反应检测金属的活动性顺序,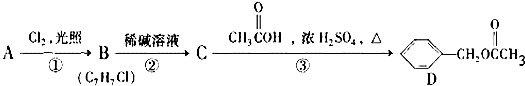
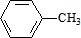 ,C的名称:苯甲醇.
,C的名称:苯甲醇.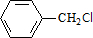 +NaOH$→_{△}^{H_{2}O}$
+NaOH$→_{△}^{H_{2}O}$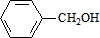 +NaCl.
+NaCl. .
.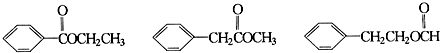 .
.