题目内容
14. 二甲醚(CH3OCH3)在未来可能替代柴油和液化气作为洁净液体燃料使用.工业上以CO和H2为原料生产CH3OCH3的新工艺主要发生三个反应:
二甲醚(CH3OCH3)在未来可能替代柴油和液化气作为洁净液体燃料使用.工业上以CO和H2为原料生产CH3OCH3的新工艺主要发生三个反应:①CO(g)+2H2(g)?CH3OH(g)△H1=-91kJ•mol-1
②2CH3OH(g)?CH3OCH3(g)+H2O(g)△H2=-24kJ•mol-1
③CO(g)+H2O(g)?CO2(g)+H2(g)△H3=-41kJ•mol-1
回答下列问题:
(1)新工艺的总反应为3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g)△H该反应△H=-247KJ•mol-1,平衡常数表达式K=$\frac{c(CH{\;}_{3}OCH{\;}_{3})•c(CO{\;}_{2})}{c{\;}^{3}(CO)•c{\;}^{3}(H{\;}_{2})}$.
(2)增大压强,CH3OCH3的产率增大(填“增大”、“减小”或“不变”).
(3)原工艺中反应①和反应②分别在不同的反应器中进行,无反应③发生.新工艺中反应③的发生提高了CH3OCH3的产率,原因是反应③消耗了反应②中的产物H2O,使反应②的化学平衡向正反应方向移动,从而提高CH3OCH3的产率.
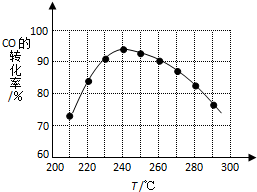
(4)为了寻找合适的反应温度,研究者进行了一系列试验,每次试验保持原料气组成、压强、反应时间等因素不变,试验结果如图.CO转化率随温度变化的规律是温度低于240℃时,CO的转化率随着温度的升高而增大;温度高于240℃时,CO的转化率随着温度的升高而减小,其原因是在较低温时,各反应体系均未达到平衡,CO的转化率主要受反应速率影响,随着温度的升高反应速率增大,CO的转化率也增大;在较高温时,各反应体系均已达到平衡,CO的转化率主要受反应限度影响,随着温度的升高平衡向逆反应方向移动,CO的转化率减小.
分析 (1)①CO( g)+2H2(g)?CH3OH( g)△H1=-91kJ•mol-1,
②2CH30H(g)?CH30CH3(g)+H20(g)△H2=-24kJ•mol-1,
③CO(g)+H2O(g)?CO2(g)+H2(g)△H3=-41kJ•mol-1,
根据盖斯定律,①×2+②+③计算△H;
平衡常数指产物浓度系数次幂的乘积与反应物浓度系数次幂的乘积的比值;
(2)反应前后气体的气体减小,增大压强平衡向体积减小的方向移动;
(3)反应③消耗了反应②中的产物H2O,使反应②的化学平衡向正反应方向移动;
(4)由图表可知,在较低温时,反应体系均未达到平衡,CO的转化率主要受反应速率影响,随着温度的升高反应速率增大,CO的转化率也增大;在较高温时,反应体系均已达到平衡,随着温度的升高平衡向逆反应方向移动,CO的转化率减小.
解答 解:(1)已知①CO( g)+2H2(g)?CH3OH( g)△H1=-91kJ•mol-1,
②2CH30H(g)?CH30CH3(g)+H20(g)△H2=-24kJ•mol-1,
③CO(g)+H2O(g)?CO2(g)+H2(g)△H3=-41kJ•mol-1,
根据盖斯定律,①×2+②+③得3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g)△H=-247kJ•mol-1,
平衡常数指产物浓度系数次幂的乘积与反应物浓度系数次幂的乘积的比值,所以K=$\frac{c(CH{\;}_{3}OCH{\;}_{3})•c(CO{\;}_{2})}{c{\;}^{3}(CO)•c{\;}^{3}(H{\;}_{2})}$,
故答案为:-247KJ•mol-1;$\frac{c(CH{\;}_{3}OCH{\;}_{3})•c(CO{\;}_{2})}{c{\;}^{3}(CO)•c{\;}^{3}(H{\;}_{2})}$;
(2)反应前后气体的气体减小,增大压强平衡向体积减小的方向移动,即向正反应方向移动,CH30CH3的产率增大,故答案为:增大;
(3)反应③生成了反应①中的反应物,使反应①的化学平衡向正反应方向移动,反应①生成反应②的反应物CH3OH,同时反应③消耗了反应②中的产物H2O,使反应②的化学平衡都向正反应方向移动,从而提高CH3OCH3的产率,故答案为:反应③消耗了反应②中的产物H2O,使反应②的化学平衡向正反应方向移动,从而提高CH3OCH3的产率;
(4)由图表可知,温度低于240℃时,CO的转化率随着温度的升高而增大;温度高于240℃时,CO的转化率随着温度的升高而减小,
在较低温时,各反应体系均未达到平衡,CO的转化率主要受反应速率影响,随着温度的升高反应速率增大,CO的转化率也增大;在较高温时,各反应体系均已达到平衡,CO的转化率主要受反应限度影响,随着温度的升高平衡向逆反应方向移动,CO的转化率减小,
故答案为:温度低于240℃时,CO的转化率随着温度的升高而增大;温度高于240℃时,CO的转化率随着温度的升高而减小;
在较低温时,各反应体系均未达到平衡,CO的转化率主要受反应速率影响,随着温度的升高反应速率增大,CO的转化率也增大;在较高温时,各反应体系均已达到平衡,CO的转化率主要受反应限度影响,随着温度的升高平衡向逆反应方向移动,CO的转化率减小.
点评 本题考查反应热的计算、平衡移动、化学平衡常数等,难度中等,难点在于读图明白温度为240℃时反应体系均已达到平衡.

| A. | HOCH2COOCH2CH3 | B. | CH3CH(OH)CH2COOH | C. | HOCH2CH2CH2COOH | D. | CH3CH2CH(OH)COOH |

| A. | M的分子式为C11H10O3 | |
| B. | M能与溴水发生加成和取代反应 | |
| C. | 1 mol M最多与3 mol NaOH反应 | |
| D. | M与苯酚属于同系物,遇FeCl3溶液呈紫色 |
| 选项 | 叙述I | 叙述II |
| A | Mg有还原性 | 电解MgCl2饱和溶液可制备Mg |
| B | AgCl难溶于酸 | 用盐酸和AgNO3溶液检验Cl- |
| C | Ba(OH)2易溶于水 | 可配制1.0mol?L-1的Ba(OH)2溶液 |
| D | NH4Cl为强酸弱碱盐 | 用加热法除去NaCl中的NH4Cl |
| A. | A | B. | B | C. | C | D. | D |

| A. | X、Y、Z三种元素最低价氢化物的沸点依次升高 | |
| B. | 由X、Y和氢三种元素形成的化合物中只有共价键 | |
| C. | 原子半径:W>X>Y | |
| D. | T元素的单质具有半导体的特性,T与Z元素可形成化合物TZ4 |
| 几种物质溶解度与温度的关系 | |||||
| 温度 | 0 | 10 | 20 | 30 | 40 |
| S(CaCl2)/g | 59.5 | 64.7 | 74.5 | 100 | 128 |
| S[Ca(ClO3)2]/g | 209 | ||||
| S(KClO3)/g | 3.3 | 5.2 | 7.3 | 10.2 | 13.9 |
(2)在80℃氯化时产生氯酸钙及氯化钙的化学方程式为6Cl2+6Ca(OH)2 $\frac{\underline{\;\;△\;\;}}{\;}$ 5CaCl2+Ca(ClO3)2+6H2O;除去溶液中多余的氯气的简单方法是将溶液加热.
(3)饱和KCl溶液能与氯酸钙反应的原因是KClO3的溶解度比Ca(ClO3)2小.
(4)滤渣中的成分主要是C、SiO2(写化学式);从过滤后的溶液中获得KClO3晶体的方法是蒸发结晶、趁热过滤、洗涤、烘干.

