题目内容
4.实验室利用电石渣(主要含CaO、CaC2及少量C、SiO2)为原料制备氯酸钾的实验流程及相关物质的溶解度如图:| 几种物质溶解度与温度的关系 | |||||
| 温度 | 0 | 10 | 20 | 30 | 40 |
| S(CaCl2)/g | 59.5 | 64.7 | 74.5 | 100 | 128 |
| S[Ca(ClO3)2]/g | 209 | ||||
| S(KClO3)/g | 3.3 | 5.2 | 7.3 | 10.2 | 13.9 |
(2)在80℃氯化时产生氯酸钙及氯化钙的化学方程式为6Cl2+6Ca(OH)2 $\frac{\underline{\;\;△\;\;}}{\;}$ 5CaCl2+Ca(ClO3)2+6H2O;除去溶液中多余的氯气的简单方法是将溶液加热.
(3)饱和KCl溶液能与氯酸钙反应的原因是KClO3的溶解度比Ca(ClO3)2小.
(4)滤渣中的成分主要是C、SiO2(写化学式);从过滤后的溶液中获得KClO3晶体的方法是蒸发结晶、趁热过滤、洗涤、烘干.

分析 电石渣(主要含CaO、CaC2及少量C、SiO2),电石渣加入水进入化灰池,碳化钙和水反应生成氢氧化钙和乙炔,通入氯气氯化和氢氧化钙反应在80℃生成氯化钙、氯酸钙和水,加入饱和KCl溶液,依据KClO3的溶解度比Ca(ClO3)2小,转化为KClO3的溶液,将溶液加热把多余的氯气除去,过滤得到滤渣主要有不溶的C、SiO2,蒸发浓缩,冷却结晶,趁热过滤得到析出KClO3的晶体,
(1)化灰池中CaC2与水反应生成氢氧化钙和乙炔;
(2)在80℃氯化时,氯气和氢氧化钙反应产生氯酸钙及氯化钙和水;
(3)饱和KCl溶液能与氯酸钙反应生成KClO3;
(4)上述分析可知过滤得到滤渣主要有不溶的C、SiO2,蒸发浓缩,冷却结晶,趁热过滤得到析出KClO3的晶体.
解答 解:电石渣(主要含CaO、CaC2及少量C、SiO2),电石渣加入水进入化灰池,碳化钙和水反应生成氢氧化钙和乙炔,通入氯气氯化和氢氧化钙反应在80℃生成氯化钙、氯酸钙和水,加入饱和KCl溶液,依据KClO3的溶解度比Ca(ClO3)2小,转化为KClO3的溶液,将溶液加热把多余的氯气除去,过滤得到滤渣主要有不溶的C、SiO2,蒸发浓缩,冷却结晶,趁热过滤得到析出KClO3的晶体,
(1)化灰池中CaC2与水反应生成氢氧化钙和乙炔,反应的化学方程式为:CaC2+2H2O→Ca(OH)2+HC≡CH↑,
故答案为:CaC2+2H2O→Ca(OH)2+HC≡CH↑;
(2)在80℃氯化时,氯气和氢氧化钙反应产生氯酸钙及氯化钙和水,反应的化学方程式为:6Cl2+6Ca(OH)2 $\frac{\underline{\;\;△\;\;}}{\;}$ 5CaCl2+Ca(ClO3)2+6H2O,除去溶液中多余的氯气的简单方法是将溶液加热除去,
故答案为:6Cl2+6Ca(OH)2 $\frac{\underline{\;\;△\;\;}}{\;}$ 5CaCl2+Ca(ClO3)2+6H2O,溶液加热除去;
(3)饱和KCl溶液能与氯酸钙反应的原因是,KClO3的溶解度比Ca(ClO3)2小,饱和KCl溶液能与氯酸钙反应生成KClO3,
故答案为:KClO3的溶解度比Ca(ClO3)2小;
(4)上述分析可知过滤得到滤渣主要有不溶的C、SiO2,蒸发浓缩,冷却结晶,趁热过滤得到析出KClO3的晶体,故答案为:C、SiO2;蒸发结晶;趁热过滤.
点评 本题考查了物质分离提纯的过程分析判断,实验条件和物质性质的理解应用,实验设计和反应产物的判断是晶体关键,题目难度中等.

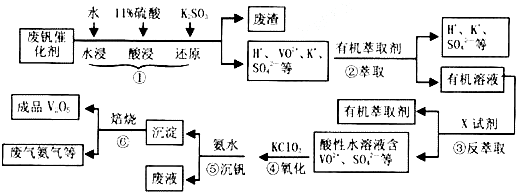
(1)步骤①中废渣的主要成分是SiO2,③中X试剂为H2SO4.
(2)②、③的变化过程可简化为R2(SO4)n (水层)+2nHA(有机层)?2RAn(有机层)+nH2SO4(水层)(R表示VO2+,HA表示有机萃取剂).为提高②中萃取百分率,应采取的措施是加入碱中和硫酸使平衡正移.
(3)请完成④中反应的离子方程式:
ClO3-+6VO2++6H+═6VO3++1Cl-+H2O.
(4)25℃时,取样进行试验分析,得到钒沉淀率和溶液pH之间关系如下表:
| pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
| 钒沉淀率/% | 88.1 | 94.8 | 96.5 | 98.0 | 98.8 | 98.8 | 96.4 | 93.1 | 89.3 |
(5)该工艺流程中,可以循环利用的物质有有机萃取剂、氨气.
 ,有关其结构说法正确的是( )
,有关其结构说法正确的是( )| A. | 所有原子可能在同一平面上 | B. | 所有碳原子可能在同一平面上 | ||
| C. | 有7个碳原子在同一条直线上 | D. | 有5个碳原子在同一直线上 |
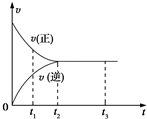 图中是可逆反应X2+3Y2?2Z2在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述正确的是( )
图中是可逆反应X2+3Y2?2Z2在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述正确的是( )| A. | t1时,V(正)>V(逆) | B. | t1~t2,X2的物质的量越来越多 | ||
| C. | t2~t3,各物质的浓度不再发生变化 | D. | t2~t3,反应不再发生 |
 已知A为金属单质,根据下列变化完成以下问题:
已知A为金属单质,根据下列变化完成以下问题: 二甲醚(CH3OCH3)在未来可能替代柴油和液化气作为洁净液体燃料使用.工业上以CO和H2为原料生产CH3OCH3的新工艺主要发生三个反应:
二甲醚(CH3OCH3)在未来可能替代柴油和液化气作为洁净液体燃料使用.工业上以CO和H2为原料生产CH3OCH3的新工艺主要发生三个反应: X、Y、Z、W、R、Q为前30号元素,且原子序数依次增大.X是所有元素中原子半径最小的,Y有三个能级,且每个能级上的电子数相等,Z原子单电子数在同周期元素中最多,W与Z同周期,第一电离能比Z的低,R与Y同一主族,Q的最外层只有一个电子,其他电子层电子均处于饱和状态.请回答下列问题:
X、Y、Z、W、R、Q为前30号元素,且原子序数依次增大.X是所有元素中原子半径最小的,Y有三个能级,且每个能级上的电子数相等,Z原子单电子数在同周期元素中最多,W与Z同周期,第一电离能比Z的低,R与Y同一主族,Q的最外层只有一个电子,其他电子层电子均处于饱和状态.请回答下列问题: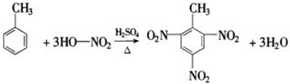

 -CH2CH3+18KMnO4+27H2SO4→5HOOC-
-CH2CH3+18KMnO4+27H2SO4→5HOOC- -COOH+9K2SO4+18MnSO4+5CO2↑+42H2O
-COOH+9K2SO4+18MnSO4+5CO2↑+42H2O