题目内容
5.下列物质:①H2 ②HF ③H2O2④KF ⑤NH4Cl ⑥C2H2 ⑦N2H4+ ⑧BF3 ⑨H2O ⑩N2(填序号)(1)只含非极性键的是①⑩
(2)只含极性键的极性分子是②⑨
(3)既有极性键又有非极性键的是③⑥⑦
(4)只有σ键的是①②⑦⑧⑨
(5)既有σ键又有π键的是⑥⑩
(6)含有配位键的是⑤⑦.
分析 一般来说,金属与非金属形成离子键、非金属之间形成共价键,同种非金属之间形成非极性键,不同非金属形成极性键,由提供孤对电子和空轨道的形成配位键,以此来解答.
解答 解:①H2中只含非极性共价键,为非极性分子;
②HF中只含极性键,为极性分子;
③H2O2中含非极性共价键和极性共价键,为极性分子;
④KF中只含离子键;
⑤NH4Cl中含离子键和配位键;
⑥C2H2中含非极性共价键和极性共价键,直线结构,为非极性分子;
⑦N2H4+中含非极性共价键和极性共价键,且含配位键;
⑧BF3中含极性共价键,平面三角形,为非极性分子;
⑨H2O中含极性共价键,V型结构,为极性分子;
⑩N2中只含非极性共价键,为非极性分子,
(1)只含非极性键的是①⑩,故答案为:①⑩;
(2)只含极性键的极性分子是②⑨,故答案为:②⑨;
(3)既有极性键又有非极性键的是③⑥⑦,故答案为:③⑥⑦;
(4)单键均为σ键,只有σ键的是①②⑦⑧⑨,故答案为:①②⑦⑧⑨;
(5)双键或三键中既有σ键又有π键,则既有σ键又有π键的是⑥⑩,故答案为:⑥⑩;
(6)含有配位键的是⑤⑦,故答案为:⑤⑦.
点评 本题考查化学键和类型,为高频考点,把握化学键的形成及判断的一般规律为解答的关键,侧重分析与应用能力的考查,综合性较强,注意配位键为解答的难点,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
13.某烃结构式如下: ,有关其结构说法正确的是( )
,有关其结构说法正确的是( )
 ,有关其结构说法正确的是( )
,有关其结构说法正确的是( )| A. | 所有原子可能在同一平面上 | B. | 所有碳原子可能在同一平面上 | ||
| C. | 有7个碳原子在同一条直线上 | D. | 有5个碳原子在同一直线上 |
20.下列过程中,离子键被破坏的是( )
| A. | 溴挥发 | B. | 氯气被木炭吸附 | C. | 硫酸溶于水 | D. | 食盐溶于水 |
10.科学家预测原子序数为114的元素具有相当稳定的核素,它在元素周期表中的位置在第7周期ⅣA族,位于铅的下方,称为类铅.下列关于它的性质叙述中,错误的是( )
| A. | 它的最高价氧化物的水化物是强酸 | B. | 它的金属性比铅强 | ||
| C. | 它具有7个电子层 | D. | 它的最外层电子数为4 |
17.某元素最高价氧化物对应水化物的化学式为H2XO3,这种元素的气态氢化物的化学式是( )
| A. | HX | B. | XH4 | C. | XH3 | D. | H2X |
14.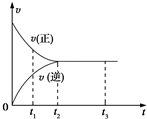 图中是可逆反应X2+3Y2?2Z2在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述正确的是( )
图中是可逆反应X2+3Y2?2Z2在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述正确的是( )
 图中是可逆反应X2+3Y2?2Z2在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述正确的是( )
图中是可逆反应X2+3Y2?2Z2在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述正确的是( )| A. | t1时,V(正)>V(逆) | B. | t1~t2,X2的物质的量越来越多 | ||
| C. | t2~t3,各物质的浓度不再发生变化 | D. | t2~t3,反应不再发生 |
15.下列描述中正确的是( )
| A. | CS2为Ⅴ形的极性分子 | |
| B. | ClO3-的空间构型为平面三角形 | |
| C. | SF6中S原子为sp6杂化 | |
| D. | SiF4和SO32-的中心原子均为sp3杂化 |
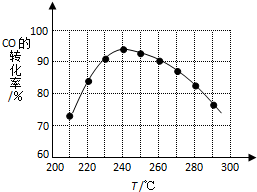 二甲醚(CH3OCH3)在未来可能替代柴油和液化气作为洁净液体燃料使用.工业上以CO和H2为原料生产CH3OCH3的新工艺主要发生三个反应:
二甲醚(CH3OCH3)在未来可能替代柴油和液化气作为洁净液体燃料使用.工业上以CO和H2为原料生产CH3OCH3的新工艺主要发生三个反应: