题目内容
8.下列离子方程式书写正确的是( )| A. | NH4HCO3溶液与过量NaOH溶液反应:NH4++OH-=NH2.H2O | |
| B. | 高锰酸钾酸性溶液吸收二氧化硫:5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+ | |
| C. | Fe3O4与稀HNO3反应:Fe3O4+8H+=Fe2++2Fe3++4H2O | |
| D. | 氯气溶于水:Cl2+H2O=2H++Cl-+ClO- |
分析 A.氢氧化钠过量,碳酸氢根离子、氨根离子都反应;
B.二氧化硫具有还原性,能够被酸性的高锰酸钾氧化生成硫酸根离子;
C.Fe3O4与稀HNO3反应生成硝酸铁、一氧化氮和水;
D.次氯酸为弱电解质,应保留化学式.
解答 解:A.NH4HCO3溶液与过量NaOH溶液反应,离子方程式:HCO3-+NH4++2OH-=NH2.H2O+H2O+CO32-,故A错误;
B.高锰酸钾酸性溶液吸收二氧化硫发生氧化还原反应,离子方程式:5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+,故B正确;
C.Fe3O4与稀HNO3反应离子方程式:NO3-+3Fe3O4+28H+=NO↑+9Fe3++14H2O,故C错误;
D.氯气溶于水反应生成氯化氢和次氯酸,离子方程式:Cl2+H2O=H++Cl-+HClO,故D错误;
故选:B.
点评 本题考查了离子方程式书写,明确反应实质和离子反应发生条件是解题关键,注意化学式的拆分,选项C为易错选项,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
18.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 4gNaOH固体所含电子总数为2NA | |
| B. | 22.4LC2H6所含化学键总数为7 NA | |
| C. | 常温常压下,14gC0、N2混合气体所含分子总数为NA | |
| D. | 0.1 mol-1LNH4C1溶液中,NH4+与Cl一数之和小于0.2 NA |
19.下列4个坐标图分别表示4个实验过程中某些质量的变化,其中正确的是( )
| A | B | C | D |
| 向一定量铁粉中滴加稀盐酸 | 向一定量硫酸铜溶液中不断加入锌粉 | 加热一定量高锰酸钾固体 | 向一定量氢氧化钠 溶液中滴加稀盐酸 |
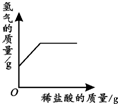 | 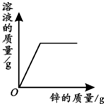 |  | 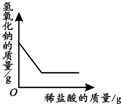 |
| A. | A | B. | B | C. | C | D. | D |
16.下列解释实验事实的方程式正确的是( )
| A. | 纯碱溶液可以清洗油污的原因:CO32-+2H2O?H2CO3+2OH- | |
| B. | 在强碱溶液中NaClO与Fe(OH)3反应制备Na2FeO4:3ClO-+2Fe(OH)3+4OH?=2FeO42-+3Cl-+5H2O | |
| C. | 铜制品表面的水膜酸性较强时,发生电化学腐蚀,正极反应为2H++2e-=H2↑ | |
| D. | 向AgNO3溶液中加过量NaCl后再加Na2S溶液,白色沉淀变黑色 2Ag++S2-=Ag2S↓ |
3.治理氮氧化物污染的方法之一是用NaOH溶液进行吸收,反应原理如下:NO2+NO+2NaOH=2NaNO2+H2O,2NO2+2NaOH=NaNO2+NaNO3+H2O.某学生在实验室用一定量的铜与足量的硝酸反应,收集到标准状况下NO、NO2和N2O4的混合气体共aL.若将上述混合气体通入1L 1mol/L的NaOH溶液中恰好被完全吸收.下列分析错误的是( )
| A. | 11.2L<a<22.4L | |
| B. | 若a=16.8L,V(N2O4)=5.6L | |
| C. | 若a=16.8L,n(NaNO2):n(NaNO3)=4:1 | |
| D. | 若混合气体与NaOH溶液反应只生成一种盐,则n(NO)=0.5mol |
13.下列解释事实的方程式正确的是( )
| A. | 钢铁生锈,负极反应式为:Fe-3e-=Fe3+ | |
| B. | 用石墨做电极电解硫酸铜溶液,有Cu和O2析出:2Cu2++4OH-$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+2H2O | |
| C. | Na2CO3溶液滴加酚酞,溶液变红:CO32-+2H2O?H2CO3+2OH- | |
| D. | 酸性高锰酸钾溶液中加入草酸钠,溶液褪色:2MnO4-+5C2O42-+16H+=2Mn2++10CO2↑+8H2O |
20.如图是部分短周期元素原子(用字母表示)最外层电子数与原子序数的关系图.下列说法正确的是( )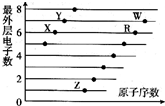

| A. | ZY、ZW的水溶液都显酸性 | |
| B. | 原子半径大小:W>R>X,离子半径大小:Z+>R2->W->Y- | |
| C. | W的氢化物水溶液的酸性比R的氢化物水溶液的酸性强,可证明非金属性:W>R | |
| D. | Z、X两种元素形成的Z2X、Z2X2为离子化合物 |
17.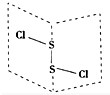 二氯化硫(S2Cl2)是广泛用于橡胶工业的硫化剂,其分子结构如右图所示.常温下,S2Cl2是一种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体.化学方程式为2S2Cl2+2H2O═SO2↑+3S↓+4HCl,下列说法中错误的是( )
二氯化硫(S2Cl2)是广泛用于橡胶工业的硫化剂,其分子结构如右图所示.常温下,S2Cl2是一种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体.化学方程式为2S2Cl2+2H2O═SO2↑+3S↓+4HCl,下列说法中错误的是( )
 二氯化硫(S2Cl2)是广泛用于橡胶工业的硫化剂,其分子结构如右图所示.常温下,S2Cl2是一种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体.化学方程式为2S2Cl2+2H2O═SO2↑+3S↓+4HCl,下列说法中错误的是( )
二氯化硫(S2Cl2)是广泛用于橡胶工业的硫化剂,其分子结构如右图所示.常温下,S2Cl2是一种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体.化学方程式为2S2Cl2+2H2O═SO2↑+3S↓+4HCl,下列说法中错误的是( )| A. | S2Cl2的电子式为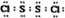 | |
| B. | 反应中SO2是还原产物,S是氧化产物 | |
| C. | S2Cl2为含有极性键和非极性键的极性分子 | |
| D. | 反应中,生成1molSO2,转移电子为3mol |
18.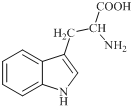 色氨酸是植物体内生长素生物合成重要的前体物质,普遍存在于高等植物中.纯净的色氨酸为白色或微黄色结晶,微溶于水易溶于盐酸或氢氧化钠,其结构如图所示,下列关于色氨酸的说法不正确的是( )
色氨酸是植物体内生长素生物合成重要的前体物质,普遍存在于高等植物中.纯净的色氨酸为白色或微黄色结晶,微溶于水易溶于盐酸或氢氧化钠,其结构如图所示,下列关于色氨酸的说法不正确的是( )
 色氨酸是植物体内生长素生物合成重要的前体物质,普遍存在于高等植物中.纯净的色氨酸为白色或微黄色结晶,微溶于水易溶于盐酸或氢氧化钠,其结构如图所示,下列关于色氨酸的说法不正确的是( )
色氨酸是植物体内生长素生物合成重要的前体物质,普遍存在于高等植物中.纯净的色氨酸为白色或微黄色结晶,微溶于水易溶于盐酸或氢氧化钠,其结构如图所示,下列关于色氨酸的说法不正确的是( )| A. | 色氨酸的分子式为C11H12N2O2 | |
| B. | 色氨酸能发生取代、加成、酯化、中和反应 | |
| C. | 色氨酸微溶于水而易溶于酸或碱溶液是因为其与酸、碱都能反应生成盐 | |
| D. | 将色氨酸与甘氨酸(NH2CH2COOH)混合,在一定条件下最多可形成三种二肽 |