��Ŀ����
15��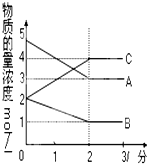 �ں����ܱ������У�ij��Ӧ�ڲ�ͬ��Ӧʱ������ʵ���Ũ�ȵı仯�����ͼ��ʾ�������ʾ�Ϊ���壩����ش��������⣺
�ں����ܱ������У�ij��Ӧ�ڲ�ͬ��Ӧʱ������ʵ���Ũ�ȵı仯�����ͼ��ʾ�������ʾ�Ϊ���壩����ش��������⣺��1���÷�Ӧ�Ļ�ѧ����ʽΪ2A��g��+B��g��?2C��g����
��2����Ӧ��ʼ��2����ʱ����C��ʾ��Ӧ����Ϊ1mol/��L•min����ƽ��ʱA��ת����Ϊ40%��
��3�������������䣬����3min�����������±仯ʱ���ܼӿ컯ѧ��Ӧ���ʵ��Ǣ٢ۣ�
�ټ��루�������� �ڳ���һ����He �۳���һ������A �ܽ����¶ȣ�
���� ��1���������ʵ����ı仯�жϷ�Ӧ���������������ʵ����ı仯֮�ȵ��ڻ�ѧ������֮����д����ʽ��
��2������v=$\frac{��c}{��t}$���㷴Ӧ���ʣ�����Ũ��c=$\frac{n}{V}$������A�ı仯����A����ʼ��֮�����ת����=$\frac{������}{��ʼ��}$��100%��
��3������Ӱ�컯ѧ��Ӧ���ʵ����ط���������ѹǿ��Ũ�ȡ������¶ȡ���������ȶ���������Ӧ���ʣ��ݴ˷���ѡ�
��� �⣺��1����ͼ����Կ�������Ӧ��A��B�����ʵ�����С��C�����ʵ������࣬��A��BΪ��Ӧ�CΪ�����������ͬһ�����У�Ũ��֮�ȵ������ʵ���֮�ȣ����С�n��A������n��B������n��C��=2mol��1mol��2mol=2��1��2����Ӧ�Ļ�ѧ����ʽΪ2A��g��+B��g��?2C��g����
�ʴ�Ϊ��2A��g��+B��g��?2C��g����
��2����Ӧ��ʼ��2����ʱ����C��ʾ��Ӧ����Ϊ$\frac{4mol/L-2mol/L}{2min}$=1mol/��L•min����ƽ��ʱA��ת����Ϊ$\frac{5mol/L-3mol/L}{5mol/L}$��100%=40%��
�ʴ�Ϊ��1��40%��
��3���ټ��루���������ӿ췴Ӧ���ʣ��ʢ���ȷ��
�ڳ���һ����He����ѹ�����ѹ���䣬��Ӧ���ʲ��䣬ƽ�ⲻ�䣬�ʢڴ���
�۳���һ������A���еȷ�Ӧ��Ũ�ȷ�Ӧ�������ʢ���ȷ��
�ܽ����¶ȷ�Ӧ���ʼ�С���ʢܴ���
�ʴ�Ϊ���٢ۣ�
���� ���⿼���˻�ѧ����ʽ����д����Ӧ���ʡ�ת���ʵļ��㡢ƽ��״̬���жϡ�Ӱ�컯ѧ��Ӧ���ʵ����ص�֪ʶ������Ĺؼ���Ҫ��ѧ����ȷ��ͼ����ͼ���л�ȡ������Ϣ���еȵ��Ѷȣ�

| A�� | ŨH2SO4 | B�� | ��ʯ�� | C�� | P2O5 | D�� | ��ˮCaCl2 |
| A�� | ��ϵͳ���������л��� ��������2��2��4��5-�ļ�-3��3-���һ����� ��������2��2��4��5-�ļ�-3��3-���һ����� | |
| B�� | �����ױ������ױ���Ϊͬϵ�����ʹ���Ը��������Һ��ɫ | |
| C�� | �������ı�����Ȳ����ϩ�ͼ���ֱ��������г��ȼ�գ������ĵ����������������� | |
| D�� | 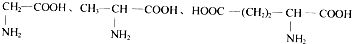 ���ְ�����֮����ˮ����������6�ֶ��� ���ְ�����֮����ˮ����������6�ֶ��� |
b������ʹˮ�ֽ����⣺2H2O$\frac{\underline{\;����\;}}{\;}$2H2��+O2��
c��̫������ֽ�ˮ���⣺2H2O$\frac{\underline{\;\;\;TiO_{2}\;\;\;}}{̫����}$2H2��+O2��
d����Ȼ�����⣺CH4+H2O$\frac{\underline{\;����\;}}{\;}$CO+3H2 ����˵����ȷ���ǣ�������
| A�� | ����d����Ϊ���ܵ�һ�ַ��� | |
| B�� | ����a��d�У�H2O�����еĹ��ۼ�ȫ������ | |
| C�� | H2O��H2O2�����Ļ�ѧ��������ȫ��ͬ | |
| D�� | H2O�ǹ��ۻ����CH4�����ӻ����� |
| A�� | I2���� | B�� | NaCl���������� | ||
| C�� | H2SO4����ˮ��������Һ | D�� | NaOH�����ۻ� |
 �����йؼ�ζ������˵���в���ȷ���ǣ�������
�����йؼ�ζ������˵���в���ȷ���ǣ�������| A�� | ��ζ��������һ������������һ�ַ����廯���� | |
| B�� | ��ζ������������ˮ�����ӳɺ�ȡ����Ӧ���������Ȼ�����Һ������ɫ��Ӧ | |
| C�� | ��ζ����������������ʮ����ԭ����ͬһƽ���� | |
| D�� | 1mol��ζ�����ֱ�����������ˮ��Ӧʱ���������4molH2��4molBr2 |
| A�� | ��ϵͳ���������л���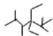 �������� 2��2��4��5-�ļ�-3��3-���һ����� �������� 2��2��4��5-�ļ�-3��3-���һ����� | |
| B�� | �����ױ������ױ���Ϊͬϵ�����ʹ���Ը��������Һ��ɫ | |
| C�� | �������ı�����Ȳ��CH��CH������ϩ�ͼ���ֱ��������г��ȼ�գ������ĵ����������������� | |
| D�� | 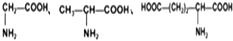 ���ְ�����֮����ˮ����������6�ֶ��� ���ְ�����֮����ˮ����������6�ֶ��� |
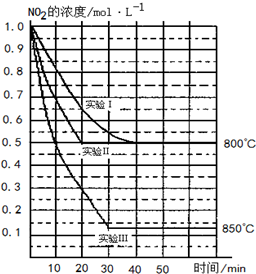 ij�����£���2L�ܱ������з������·�Ӧ��2NO2��g��?2NO��g��+O2��g���������ֲ�ͬ�����½��У�����ʵ�����800�棬ʵ�����850�棬NO��O2����ʼŨ�ȶ�Ϊ0��NO2��Ũ�ȣ�mol•L-1����ʱ�䣨min���ı仯��ͼ��ʾ����ش��������⣺
ij�����£���2L�ܱ������з������·�Ӧ��2NO2��g��?2NO��g��+O2��g���������ֲ�ͬ�����½��У�����ʵ�����800�棬ʵ�����850�棬NO��O2����ʼŨ�ȶ�Ϊ0��NO2��Ũ�ȣ�mol•L-1����ʱ�䣨min���ı仯��ͼ��ʾ����ش��������⣺