题目内容
14.用KMnO4氧化密度为1.19g/cm3,溶质质量为36.5%的HCl溶液.反应方程式为:2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O,该反应中还原剂和氧化剂的物质的量之比为5:1,若HCl溶液足量,当15.8g KMnO4参与反应时,至少需要盐酸的体积是67.2mL.(保留小数点后一位数字)分析 c(HCl)=$\frac{1000ρω}{M}$=$\frac{1000×1.19g/L×36.5%}{36.5g/mol}$=11.9mol/L,反应2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O中,Mn元素化合价由+7价降低到+2价,被还原,KMnO4为氧化剂,Cl元素化合价由-1价升高到0价,被氧化,HCl还原剂,结合反应的化学方程式计算.
解答 解:反应2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O中,Mn元素化合价由+7价降低到+2价,被还原,KMnO4为氧化剂,Cl元素化合价由-1价升高到0价,被氧化,HCl还原剂,其中16molHCl参加反应被氧化的HCl为10mol,则还原剂和氧化剂的物质的量之比为10:2=5:1;
c(HCl)=$\frac{1000ρω}{M}$=$\frac{1000×1.19g/L×36.5%}{36.5g/mol}$=11.9mol/L,
n(KMnO4)=$\frac{15.8g}{158g/mol}$=0.1mol,由方程式可知,2molKMnO4参加反应,有10molHCl被氧化,则0.1molKMnO4参加反应消耗0.8molHCl,
则至少需要盐酸的体积是V=$\frac{n}{c}$=$\frac{0.8mol}{11.9mol/L}$=0.0672L=67.2mL;
故答案为:5:1;67.2.
点评 本题考查氧化还原反应的计算,把握反应中元素的化合价变化为解答的关键,侧重计算能力、分析能力的考查,题目难度不大.

练习册系列答案
相关题目
2.下列除去杂质所选试剂和方法均正确的是( )
| A. | 除去乙酸乙酯中少量的乙酸:加入少量乙醇,将其转化为乙酸乙酯 | |
| B. | 除去Fe(OH)3胶体中的NaCl:用水溶解后过滤 | |
| C. | 除去苯中的苯酚:加入浓溴水后过滤 | |
| D. | 除去溴乙烷中的溴:加入Na2S03溶液再分液 |
9.下列各组离子,在指定的环境中能够大量共存的是( )
| A. | 有Fe3+大量存在的溶液中:Na+、Cl-、K+、SCN- | |
| B. | 滴加酚酞显红色的溶液中:NH4+、Al3+、SO42-、NO3- | |
| C. | 常温下pH=1的溶液中:Na+、K+、Cl-、S2O32- | |
| D. | 有CO32-存在的无色透明溶液中:Na+、K+、Cl-、AlO2- |
3.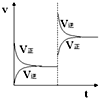 在密闭容器,一定条件下进行反应,mA(g)+nB(g)?pC(g)+qD(g),若增大压强或升高温度,重新达到平衡,变化过程均如右图所示,则对该反应叙述正确的是( )
在密闭容器,一定条件下进行反应,mA(g)+nB(g)?pC(g)+qD(g),若增大压强或升高温度,重新达到平衡,变化过程均如右图所示,则对该反应叙述正确的是( )
 在密闭容器,一定条件下进行反应,mA(g)+nB(g)?pC(g)+qD(g),若增大压强或升高温度,重新达到平衡,变化过程均如右图所示,则对该反应叙述正确的是( )
在密闭容器,一定条件下进行反应,mA(g)+nB(g)?pC(g)+qD(g),若增大压强或升高温度,重新达到平衡,变化过程均如右图所示,则对该反应叙述正确的是( )| A. | 正反应是吸热反应 | B. | 逆反应是吸热反应 | ||
| C. | m+n>p+q | D. | m+n<p+q |
1.如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.据此下列说法正确的是( )


| A. | 该试剂的物质的量浓度为9.2mol•L-1 | |
| B. | 该硫酸50mL与足量的铜反应可得到标准状况下SO2 10.3L | |
| C. | 配制50mL 4.6mol•L-1的稀硫酸需取该硫酸12.5mL | |
| D. | 该硫酸与等体积的水混合所得溶液的质量分数小于49% |
 实验室制备硝基苯的主要步骤如下:
实验室制备硝基苯的主要步骤如下:
 有剧毒
有剧毒