题目内容
9.下列各组离子,在指定的环境中能够大量共存的是( )| A. | 有Fe3+大量存在的溶液中:Na+、Cl-、K+、SCN- | |
| B. | 滴加酚酞显红色的溶液中:NH4+、Al3+、SO42-、NO3- | |
| C. | 常温下pH=1的溶液中:Na+、K+、Cl-、S2O32- | |
| D. | 有CO32-存在的无色透明溶液中:Na+、K+、Cl-、AlO2- |
分析 A.离子之间结合生成络离子;
B.滴加酚酞显红色的溶液,显碱性;
C.常温下pH=1的溶液,显酸性,离子之间发生氧化还原反应;
D.有CO32-存在的无色透明溶液,显碱性.
解答 解:A.Fe3+、SCN-结合生成络离子,不能大量共存,故A错误;
B.滴加酚酞显红色的溶液,显碱性,不能大量存在NH4+、Al3+,故B错误;
C.常温下pH=1的溶液,显酸性,H+、S2O32-发生氧化还原反应,不能大量共存,故C错误;
D.有CO32-存在的无色透明溶液,显碱性,该组离子之间不反应,可大量共存,故D正确;
故选D.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重复分解反应、氧化还原反应的离子共存考查,题目难度不大.

练习册系列答案
 同步练习强化拓展系列答案
同步练习强化拓展系列答案
相关题目
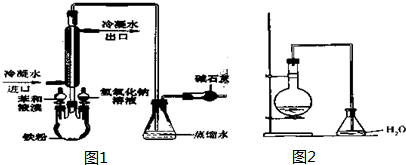
4. 醇脱水是合成烯烃的常用方法,实验室合成环已烯的反应和实验装置(夹持装置已略去)如下可能用到的有关数据如下:
醇脱水是合成烯烃的常用方法,实验室合成环已烯的反应和实验装置(夹持装置已略去)如下可能用到的有关数据如下:
合成反应: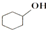 $→_{△}^{浓H_{2}SO_{4}}$
$→_{△}^{浓H_{2}SO_{4}}$ +H2O,在a中加入20g环已醇和2小片碎片,冷却搅动下慢慢加入1mL浓硫酸.B中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90℃.
+H2O,在a中加入20g环已醇和2小片碎片,冷却搅动下慢慢加入1mL浓硫酸.B中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90℃.
分离提纯:
反应粗产物倒入分液漏斗中分别用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙.最终通过蒸馏得到纯净环已烯10g.
回答下列问题:
(1)装置b的名称是冷凝管.
(2)加入碎瓷片的作用是防止暴沸;如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是B(填正确答案称号).
A.立即补加B.冷却后补加C.不需补加D.重新配料
(3)分液漏斗在使用前须清洗干净并检漏;在本实验分离过程中,产物应该从分液漏斗的上口倒出(填“上口倒出”或“下口放出”).
(4)分离提纯过程中加入无水氯化钙的目的是干燥.
 醇脱水是合成烯烃的常用方法,实验室合成环已烯的反应和实验装置(夹持装置已略去)如下可能用到的有关数据如下:
醇脱水是合成烯烃的常用方法,实验室合成环已烯的反应和实验装置(夹持装置已略去)如下可能用到的有关数据如下:| 相对分子质量 | 密度(g•cm-3) | 沸点(℃) | 溶解性 | |
| 环已醇 | 100 | 0.9618 | 161 | 微溶于水 |
| 环已烯 | 82 | 0.8102 | 83 | 难溶于水 |
 $→_{△}^{浓H_{2}SO_{4}}$
$→_{△}^{浓H_{2}SO_{4}}$ +H2O,在a中加入20g环已醇和2小片碎片,冷却搅动下慢慢加入1mL浓硫酸.B中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90℃.
+H2O,在a中加入20g环已醇和2小片碎片,冷却搅动下慢慢加入1mL浓硫酸.B中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90℃.分离提纯:
反应粗产物倒入分液漏斗中分别用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙.最终通过蒸馏得到纯净环已烯10g.
回答下列问题:
(1)装置b的名称是冷凝管.
(2)加入碎瓷片的作用是防止暴沸;如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是B(填正确答案称号).
A.立即补加B.冷却后补加C.不需补加D.重新配料
(3)分液漏斗在使用前须清洗干净并检漏;在本实验分离过程中,产物应该从分液漏斗的上口倒出(填“上口倒出”或“下口放出”).
(4)分离提纯过程中加入无水氯化钙的目的是干燥.
15.各组性质比较的表示中,正确的是( )
| A. | 沸点:Cl2<2<Br2<I2 | B. | 沸点:HF<HCl<HBr<HI | ||
| C. | 氧化性:F2<Cl2<Br2<I2 | D. | 还原性:HF<HCl<HBr<HI |
16.下列说法不正确的是( )
| A. | 金属单质和盐溶液的反应不一定是置换反应 | |
| B. | “水滴石穿”是因为CaCO3与CO2、水发生了化学反应 | |
| C. | 纯碱是制作面包等糕点的膨松剂,也是治疗胃酸过多的一种药剂 | |
| D. | 少量液溴可用水封存,防止溴挥发 |
 .
.