题目内容
3.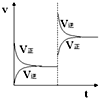 在密闭容器,一定条件下进行反应,mA(g)+nB(g)?pC(g)+qD(g),若增大压强或升高温度,重新达到平衡,变化过程均如右图所示,则对该反应叙述正确的是( )
在密闭容器,一定条件下进行反应,mA(g)+nB(g)?pC(g)+qD(g),若增大压强或升高温度,重新达到平衡,变化过程均如右图所示,则对该反应叙述正确的是( )| A. | 正反应是吸热反应 | B. | 逆反应是吸热反应 | ||
| C. | m+n>p+q | D. | m+n<p+q |
分析 依据图象分析判断,改变条件逆反应速率大于正反应速率,说明平衡向逆反应方向移动,根据化学平衡移动原理分析,升温向吸热反应方向进行;增大压强平衡向气体体积减小的方向进行;
解答 解:A、升高温度,平衡逆向进行,说明反应正向是放热反应,故A错误;
B、升高温度,平衡逆向进行,说明逆向是吸热反应,反应正向是放热反应,故B正确;
C、增大压强平衡向逆向进行,说明逆向是气体体积减小的反应,m+n<p+q,故C错误;
D、增大压强平衡向逆向进行,说明逆向是气体体积减小的反应,m+n<p+q,故D正确;
故选BD.
点评 本题考查了化学平衡的影响因素分析,化学平衡移动原理的理解和熟练掌握是解题关键,题目较简单.

练习册系列答案
 步步高达标卷系列答案
步步高达标卷系列答案
相关题目
8.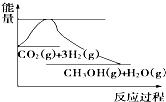 实现“节能减排”和“低碳经济”的一项重要课题就是如何将CO2转化为可利用的资源.目前工业方法是用CO2来生产燃料甲醇.一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),下图表示该反应过程中能量(单位为kJ•mol-1)的变化:关于该反应的下列说法中,正确的是( )
实现“节能减排”和“低碳经济”的一项重要课题就是如何将CO2转化为可利用的资源.目前工业方法是用CO2来生产燃料甲醇.一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),下图表示该反应过程中能量(单位为kJ•mol-1)的变化:关于该反应的下列说法中,正确的是( )
 实现“节能减排”和“低碳经济”的一项重要课题就是如何将CO2转化为可利用的资源.目前工业方法是用CO2来生产燃料甲醇.一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),下图表示该反应过程中能量(单位为kJ•mol-1)的变化:关于该反应的下列说法中,正确的是( )
实现“节能减排”和“低碳经济”的一项重要课题就是如何将CO2转化为可利用的资源.目前工业方法是用CO2来生产燃料甲醇.一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),下图表示该反应过程中能量(单位为kJ•mol-1)的变化:关于该反应的下列说法中,正确的是( )| A. | △H<0,△S<0 | B. | △H>0,△S<0 | C. | △H>0,△S>0 | D. | △H<0,△S>0 |
15.各组性质比较的表示中,正确的是( )
| A. | 沸点:Cl2<2<Br2<I2 | B. | 沸点:HF<HCl<HBr<HI | ||
| C. | 氧化性:F2<Cl2<Br2<I2 | D. | 还原性:HF<HCl<HBr<HI |
12.已知:C(s)+CO2(g)?2CO(g)△H>0.当反应达到平衡时,下列措施:
①升温 ②恒容通入惰性气体 ③增加CO2的浓度 ④减压 ⑤加催化剂 ⑥恒压通入惰性气体⑦增加Fe的物质的量,能提高CO2转化率的是( )
①升温 ②恒容通入惰性气体 ③增加CO2的浓度 ④减压 ⑤加催化剂 ⑥恒压通入惰性气体⑦增加Fe的物质的量,能提高CO2转化率的是( )
| A. | ①②⑦ | B. | ②③⑤ | C. | ①④⑥ | D. | ③⑤⑥ |
13.为了测定酸碱反应的反应热,计算时至少需要的数据是( )
①酸的浓度和体积 ②碱的浓度和体积 ③比热容 ④反应后溶液的质量
⑤反应前后溶液温度变化 ⑥操作所需的时间.
①酸的浓度和体积 ②碱的浓度和体积 ③比热容 ④反应后溶液的质量
⑤反应前后溶液温度变化 ⑥操作所需的时间.
| A. | ①②③⑤ | B. | ①③④⑥ | C. | ③④⑤⑥ | D. | 全部 |