题目内容
8.在某温度下,将某NaOH溶液和0.1mol•L-1的HAc溶液充分混合后,则该混合溶液中有关离子的浓度应满足的关系是( )| A. | [Na+]>[Ac-] | B. | [Na+]>[Ac-] | C. | [Na+]<[Ac-] | D. | [Na+]+[H+]=[OH-]+[Ac-] |
分析 在某温度下,将某NaOH溶液和0.1mol/L的CH3COOH溶液充分混合后,若溶液呈中性,溶液中[H+]=[OH-],则[Na+]=[Ac-];若为酸性,则[H+]>[OH-],则[Na+]<[Ac-];若为碱性,则[H+]<[OH-],则[Na+]>[Ac-];溶液中一定存在电荷守恒:[Na+]+[H+]=[OH-]+[Ac-],据此进行判断.
解答 解:混合液中离子浓度大小需要根据溶液酸碱性判断,若溶液呈中性,则[H+]=[OH-],根据电荷守恒可得:[Na+]=[Ac-];若为酸性,则[H+]>[OH-]、[Na+]<[Ac-];若为碱性,则[H+]<[OH-]、[Na+]>[Ac-],故A、B、C不一定正确;
溶液中一定存在电荷守恒:[Na+]+[H+]=[OH-]+[Ac-],故D正确;
故选D.
点评 本题考查了离子浓度大小比较,题目难度中等,解答时注意题中条件无法判断溶液酸碱性,则无法判断各离子浓度大小,但溶液中一定存在电荷守恒;明确电荷守恒的含义及应用方法为解答关键.

练习册系列答案
 活力试卷系列答案
活力试卷系列答案 课课优能力培优100分系列答案
课课优能力培优100分系列答案
相关题目
18. 如图所示是Zn和Cu形成的原电池,下列描述合理的是( )
如图所示是Zn和Cu形成的原电池,下列描述合理的是( )
①Zn为负极,Cu为正极
②Cu极上有气泡产生
③阳离子移向Zn极
④电子从Zn极流出沿导线流向Cu极
⑤该装置能将电能转化为化学能
⑥若有0.5mol电子流经导线,则负极质量减轻16g.
 如图所示是Zn和Cu形成的原电池,下列描述合理的是( )
如图所示是Zn和Cu形成的原电池,下列描述合理的是( )①Zn为负极,Cu为正极
②Cu极上有气泡产生
③阳离子移向Zn极
④电子从Zn极流出沿导线流向Cu极
⑤该装置能将电能转化为化学能
⑥若有0.5mol电子流经导线,则负极质量减轻16g.
| A. | ①②④ | B. | ②③ | C. | ④⑤⑥ | D. | ③④⑤ |
16.下列关于乙醇在各种反应中断裂键的说法不正确的是( )


| A. | 乙醇与钠反应,键①断裂 | |
| B. | 乙醇在Ag催化作用下与O2反应,键①③断裂 | |
| C. | 乙醇完全燃烧时,只有①②键断裂 | |
| D. | 乙醇、乙酸和浓硫酸共热制乙酸乙酯,键①断裂 |
13.下列分子中所有原子都满足最外层8电子结构的是
①CO2 ②XeF6 ③PCl3 ④SO2 ⑤BF3 ⑥N2 ⑦P4 ⑧PCl5( )
①CO2 ②XeF6 ③PCl3 ④SO2 ⑤BF3 ⑥N2 ⑦P4 ⑧PCl5( )
| A. | ①③⑥⑦ | B. | ①④⑤ | C. | ①④⑥ | D. | ②③④⑤ |
17.以下实验能获得成功的是( )
| A. | 要检验某溴乙烷中的溴元素,可以加入NaOH溶液共热,冷却后滴入AgNO3溶液,观察有无浅黄色沉淀生成 | |
| B. | 用乙醇制取乙烯时所用温度计的位置与石油分馏时所用温度计的位置不同 | |
| C. | 用氨水清洗试管壁附着的银镜 | |
| D. | 制取乙炔时药品是电石和饱和食盐水,仪器用启普发生器 |
18.从化学角度分析,生活中的下列做法不正确的是( )
| A. | 用温水泡加酶洗衣粉 | |
| B. | 长期保存食用油应隔绝空气 | |
| C. | 使用加碘(KIO3)食盐时避免高温 | |
| D. | 可以在装饰材料中大量添加甲醛、苯等物质 |

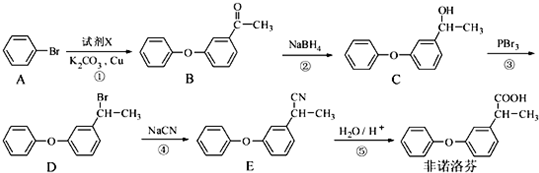
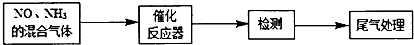
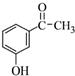 .
.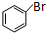 +2NaOH$\stackrel{一定条件}{→}$
+2NaOH$\stackrel{一定条件}{→}$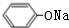 +NaBr+H2O.
+NaBr+H2O.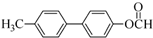 .
.