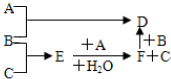
题目内容
17.以下实验能获得成功的是( )| A. | 要检验某溴乙烷中的溴元素,可以加入NaOH溶液共热,冷却后滴入AgNO3溶液,观察有无浅黄色沉淀生成 | |
| B. | 用乙醇制取乙烯时所用温度计的位置与石油分馏时所用温度计的位置不同 | |
| C. | 用氨水清洗试管壁附着的银镜 | |
| D. | 制取乙炔时药品是电石和饱和食盐水,仪器用启普发生器 |
分析 A.水解反应后溶液呈碱性,可生成AgOH;
B.用乙醇制取乙烯,温度计用于测量液体的温度,石油分馏时温度计用于测量馏分的温度;
C.氨水与银不反应;
D.乙炔与水剧烈反应,且放出大量的热.
解答 解:A.水解反应后溶液呈碱性,可生成AgOH,干扰实验现象,应水解后先加入硝酸酸化,故A错误;
B.用乙醇制取乙烯,温度计用于测量液体的温度,石油分馏时温度计用于测量馏分的温度,故B正确;
C.氨水与银不反应,应用硝酸洗涤,故C错误;
D.乙炔与水剧烈反应,且放出大量的热,且氢氧化钙易堵塞导管,不能用启普发生器,故D错误.
故选B.
点评 本题考查较为综合,涉及物质的制备、分离、检验等操作,为高考常见题型,侧重于学生的分析、实验能力的考查,注意把握实验的严密性和可行性的评价,把握物质的性质的异同,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
7.现有t℃时质量分数为a%的KNO3溶液m g,将其分成质量比为1:2的甲、乙两份溶液.甲溶液蒸发5g水,恢复到原温度时析出晶体2g;乙溶液蒸发12g水,恢复到原温度时析出晶体5g.则t℃时,KNO3溶解度为( )
| A. | 41.7 g | B. | 50 g | C. | 43 g | D. | 60 g |
8.在某温度下,将某NaOH溶液和0.1mol•L-1的HAc溶液充分混合后,则该混合溶液中有关离子的浓度应满足的关系是( )
| A. | [Na+]>[Ac-] | B. | [Na+]>[Ac-] | C. | [Na+]<[Ac-] | D. | [Na+]+[H+]=[OH-]+[Ac-] |
5.几种短周期元素的原子半径及主要化合价见下表:
下列叙述正确的是( )
| 元素代号 | M | Q | A | D | R | E | T |
| 原子半径/nm | 0.037 | 0.160 | 0.077 | 0.075 | 0.089 | 0.102 | 0.074 |
| 主要化 合价 | +1 | +2 | +4、+2 | +5、-3 | +2 | +6、-2 | -2 |
| A. | Q、R的单质与稀盐酸反应的剧烈程度Q<R | |
| B. | T、Q形成的简单离子核外电子数相同 | |
| C. | 化合物AM4、DM3、M2T的稳定性逐渐减弱 | |
| D. | 化合物M2T2、ET2均具有漂白性,且漂白原理相同 |
9.下列说法正确的是( )
| A. | 1 mol C5H12分子中,含17×6.02×1023个共用电子对 | |
| B. | 10 mL 18.4 mol•L-1的浓硫酸与90 mL蒸馏水混合,所得溶液中c(H+)=3.68 mol•L-1 | |
| C. | 25℃时,在pH=4的HCl溶液与pH=10的Na2CO3溶液中,水电离出的c(H+)前者大于后者 | |
| D. | 25℃时,在25 mL 0.1 mol•L-1NaOH溶液中,滴入0.1 mol•L-1的CH3COOH溶液至混合溶液pH=7时,则滴加CH3COOH溶液的体积大于25 mL |
7.表为元素周期表的一部分,请回答有关问题:
(1)画出①的原子结构示意图: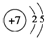 ,⑩的元素名称:溴
,⑩的元素名称:溴
(2)③④⑤原子半径由大到小的顺序是Mg>Al>Si(填元素符号)
(3)表中最活泼的金属是K,非金属性最强的元素是F;(填写元素符号)
(4)表中能形成两性氢氧化物的元素是Al,写出该元素的氢氧化物与⑨的最高价氧化物对应水化物反应的离子方程式:Al(OH)3+OH-=AlO2-+2H2O.
(5)用电子式表示③与⑥的化合物的形成过程: .
.
| IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 | |
| 2 | ① | ⑥ | ② | |||||
| 3 | ③ | ④ | ⑤ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
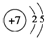 ,⑩的元素名称:溴
,⑩的元素名称:溴(2)③④⑤原子半径由大到小的顺序是Mg>Al>Si(填元素符号)
(3)表中最活泼的金属是K,非金属性最强的元素是F;(填写元素符号)
(4)表中能形成两性氢氧化物的元素是Al,写出该元素的氢氧化物与⑨的最高价氧化物对应水化物反应的离子方程式:Al(OH)3+OH-=AlO2-+2H2O.
(5)用电子式表示③与⑥的化合物的形成过程:
 .
.