题目内容
18.从化学角度分析,生活中的下列做法不正确的是( )| A. | 用温水泡加酶洗衣粉 | |
| B. | 长期保存食用油应隔绝空气 | |
| C. | 使用加碘(KIO3)食盐时避免高温 | |
| D. | 可以在装饰材料中大量添加甲醛、苯等物质 |
分析 A.适当高温能够促进蛋白质的催化效果;
B.食用油含有不饱和烃,容易氧化变质;
C.碘酸钾不稳定受热易分解;
D.甲醛、苯能够使蛋白质变性,有毒.
解答 解:A.用温水泡加酶洗衣粉,能够促进酶的催化效果,去污力强,故A正确;
B.食用油含有不饱和烃,容易氧化变质,应隔绝空气保存,故B正确;
C.碘酸钾不稳定受热易分解,应避免高温,故C正确;
D.装饰材料中大量添加甲醛、苯会造成室内污染,有害人体健康,故D错误;
故选:D.
点评 本题考查了生活中常见的化学知识,熟悉蛋白质的性质、油脂的性质、碘酸钾的性质是解题关键,题目难度不大.

练习册系列答案
 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案
相关题目
8.在某温度下,将某NaOH溶液和0.1mol•L-1的HAc溶液充分混合后,则该混合溶液中有关离子的浓度应满足的关系是( )
| A. | [Na+]>[Ac-] | B. | [Na+]>[Ac-] | C. | [Na+]<[Ac-] | D. | [Na+]+[H+]=[OH-]+[Ac-] |
9.下列说法正确的是( )
| A. | 1 mol C5H12分子中,含17×6.02×1023个共用电子对 | |
| B. | 10 mL 18.4 mol•L-1的浓硫酸与90 mL蒸馏水混合,所得溶液中c(H+)=3.68 mol•L-1 | |
| C. | 25℃时,在pH=4的HCl溶液与pH=10的Na2CO3溶液中,水电离出的c(H+)前者大于后者 | |
| D. | 25℃时,在25 mL 0.1 mol•L-1NaOH溶液中,滴入0.1 mol•L-1的CH3COOH溶液至混合溶液pH=7时,则滴加CH3COOH溶液的体积大于25 mL |
13.高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压.高铁电池的总反应为:3Zn+2K2FeO4+8H2O$?_{放电}^{充电}$3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述错误的是( )
| A. | 放电时负极反应为:Zn-2e-+2OH-═Zn(OH)2 | |
| B. | 放电时每转移3 mol 电子,正极有1 mol K2FeO4被氧化 | |
| C. | 充电时阳极反应为:Fe(OH)3-3e-+5OH-═FeO${\;}_{4}^{2-}$+4H2O | |
| D. | 充电时阴极附近溶液的碱性增强 |
3.信息、材料和能源被称为新科技革命的三大支柱.下列说法错误的是( )
| A. | 目前中美日等国掌握的陶瓷发动机技术,大大提高了发动机的能量转化效率 | |
| B. | 在即将到来的新能源时代,核能、太阳能、氢能将成为主要能源 | |
| C. | 合成高分子材料的广泛应用是有百利而无一害的 | |
| D. | 2013年6月11日发射成功的“神舟十号”载人飞船使用了大量的复合材料 |
10.目前利用废弃塑料的基本方法有:①加热熔融或粉碎后,直接用做生产新产品的材料 ②解聚成小分子物质,小分子物质又可循环再用 ③催化裂解可以制得柴油、煤油、汽油及可燃气体.其中涉及化学变化的有( )
| A. | ①和② | B. | ①和③ | C. | ②和③ | D. | 只有③ |
7.表为元素周期表的一部分,请回答有关问题:
(1)画出①的原子结构示意图: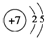 ,⑩的元素名称:溴
,⑩的元素名称:溴
(2)③④⑤原子半径由大到小的顺序是Mg>Al>Si(填元素符号)
(3)表中最活泼的金属是K,非金属性最强的元素是F;(填写元素符号)
(4)表中能形成两性氢氧化物的元素是Al,写出该元素的氢氧化物与⑨的最高价氧化物对应水化物反应的离子方程式:Al(OH)3+OH-=AlO2-+2H2O.
(5)用电子式表示③与⑥的化合物的形成过程: .
.
| IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 | |
| 2 | ① | ⑥ | ② | |||||
| 3 | ③ | ④ | ⑤ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
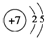 ,⑩的元素名称:溴
,⑩的元素名称:溴(2)③④⑤原子半径由大到小的顺序是Mg>Al>Si(填元素符号)
(3)表中最活泼的金属是K,非金属性最强的元素是F;(填写元素符号)
(4)表中能形成两性氢氧化物的元素是Al,写出该元素的氢氧化物与⑨的最高价氧化物对应水化物反应的离子方程式:Al(OH)3+OH-=AlO2-+2H2O.
(5)用电子式表示③与⑥的化合物的形成过程:
 .
.
9.下列叙述正确的是( )
| A. | 最外层有1个电子的元素一定是金属元素 | |
| B. | 除0族元素外,第三周期元素的原子半径不一定比第二周期元素的原子半径大 | |
| C. | 同主族元素从上到下,元素原子得电子能力逐渐减弱,氢化物的稳定性逐渐增强 | |
| D. | 主族元素的原子,最外层电子数少的一定比最外层电子数多的失电子能力强 |
