题目内容
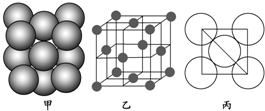
18. 如图所示是Zn和Cu形成的原电池,下列描述合理的是( )
如图所示是Zn和Cu形成的原电池,下列描述合理的是( )①Zn为负极,Cu为正极
②Cu极上有气泡产生
③阳离子移向Zn极
④电子从Zn极流出沿导线流向Cu极
⑤该装置能将电能转化为化学能
⑥若有0.5mol电子流经导线,则负极质量减轻16g.
| A. | ①②④ | B. | ②③ | C. | ④⑤⑥ | D. | ③④⑤ |
分析 Zn-Cu原电池中,Zn作负极,铜作正极,电池反应Zn+2H+=Zn2++H2↑,电子由负极流向正极,阴离子向负极移动,以此来解答.
解答 解:①该原电池中,Zn为负极,Cu为正极,故正确;
②铜电极上电极反应为2H++2e-=H2↑,发生还原反应,故正确;
③硫酸根离子向负极锌移动,故错误;
④电子由Zn电极流向Cu电极,故正确;
⑤该装置能将化学能转化为电能,故错误;
⑥若有0.5mol电子流经导线,所以质量为65×0.25=16.25g,故错误;
故选A.
点评 本题考查原电池,明确电极的判断、发生的电极反应、电子、离子的移动方向即可解答,题目难度不大.

练习册系列答案
 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案
相关题目
8.如图是我国化学家近年来合成的两种聚乙炔衍生物分子的结构式.
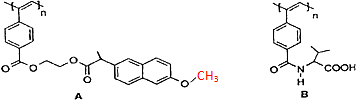
下列说法正确的是( )

下列说法正确的是( )
| A. | A和B均能在一定条件下水解,且水解均生成两种产物 | |
| B. | A水解生成的高分子化合物中所有碳原子一定共面 | |
| C. | A和B的链节中均含有2个以上手性碳原子 | |
| D. | 1molA和B各与热碱液反应,均最多消耗2n mol NaOH |
6.下列说法不正确的是( )
| A. | 已知冰的熔化热为6.0 kJ/mol,冰中氢键键能为20 kJ/mol,假设1 mol冰中有2 mol 氢键,且熔化热完全用于破坏冰的氢键,则最多只能破坏冰中15%的氢键 | |
| B. | 已知:Fe2O3(s)+3C(石墨)═2Fe(s)+3CO(g),△H=+489.0 kJ/mol CO(g)+1/2O2(g)═CO2(g),△H=-283.0 kJ/mol C(石墨)+O2(g)═CO2(g),△H=-393.5 kJ/mol 则4Fe(s)+3O2(g)═2Fe2O3(s),△H=-1641.0 kJ/mol | |
| C. | 在0.1mol/L的氨水中加水稀释,氨水的导电能力降低 | |
| D. | 已知一定温度下,醋酸溶液的物质的量浓度为c,电离度为α,Ka=$\frac{(ca)^{2}}{c(1-a)}$.若加入少量醋酸钠固体,则CH3COOH?CH3COO-+H+向左移动,α减小,Ka变小 |
13.下列各组物质的晶体中,化学键类型相同、晶体类型也相同的是( )
| A. | SO2和SiO2 | B. | CO2和H2 | C. | NaCl和HCl | D. | CCl4和KCl |
3.下列说法正确的是( )
| A. | 乙酸乙酯的制备实验中,用饱和氢氧化钠溶液来吸收随乙酸乙酯蒸出的少量乙酸和乙醇 | |
| B. | 甲烷跟氯气反应生成的CH3Cl、CH2Cl2、CHCl3、CCl4均为不溶于水的油状液体 | |
| C. | 石油的蒸馏,温度计的水银球必须插入反应液液面以下 | |
| D. | 水与金属钠反应比乙醇与金属钠反应更剧烈 |
10.下列有机反应中,不属于取代反应的是( )
| A. |  | |
| B. | 2CH3CH2+O2$→_{△}^{Cu}$2ch3CHO+2H20 | |
| C. | ClCH2=CH2+NaOH$→_{△}^{水}$HOCH2CH=CH2+NaCl | |
| D. |  |
7.现有t℃时质量分数为a%的KNO3溶液m g,将其分成质量比为1:2的甲、乙两份溶液.甲溶液蒸发5g水,恢复到原温度时析出晶体2g;乙溶液蒸发12g水,恢复到原温度时析出晶体5g.则t℃时,KNO3溶解度为( )
| A. | 41.7 g | B. | 50 g | C. | 43 g | D. | 60 g |
8.在某温度下,将某NaOH溶液和0.1mol•L-1的HAc溶液充分混合后,则该混合溶液中有关离子的浓度应满足的关系是( )
| A. | [Na+]>[Ac-] | B. | [Na+]>[Ac-] | C. | [Na+]<[Ac-] | D. | [Na+]+[H+]=[OH-]+[Ac-] |