题目内容
2.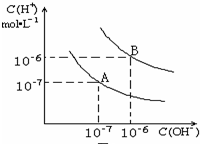 水的电离平衡曲线如图所示:
水的电离平衡曲线如图所示:(1)若以A点表示在25℃时水电离平衡时的离子浓度,当温度升高到100℃时,水的电离平衡状态到达B点,则此时水的离子积从10-14 增加到10-12.
(2)将pH=8的Ba(OH)2溶液与pH=5的稀盐酸混合,并保持25℃的恒温,致使混合溶液的pH=6,则Ba(OH)2溶液与盐酸的体积比为9:2.
分析 (1)根据Kw=c(H+).c(OH-)来计算;
(2)先根据水的离子积常数计算氢氧化钡溶液中c(OH-),再根据盐酸和氢氧化钡之间的关系计算氢氧化钡和盐酸的体积之比.
解答 解:(1)25℃时纯水中C(H+)=C(OH-)=10-7 mol/L,Kw=c(H+).c(OH-)=10-14 ,当温度升高到100℃,纯水中c(H+)=c(OH-)=10-6 mol/L,Kw=c(H+).c(OH-)=10-12 ;
故答案为:10-14 ;10-12;
(2)将pH=8的Ba(OH)2溶液中c(OH-)=10-4mol/L,pH=5的稀盐酸中c(H+)=10-5 mol/L,
设氢氧化钡的体积为x,盐酸的体积为y,保持25℃的恒温,致使混合溶液的pH=6,
c(H+)=$\frac{1{0}^{-5}y-1{0}^{-4}x}{x+y}$=10-6 mol/L,解得x:y=9:2,
故答案为:9:2.
点评 本题考查了离子积常数的有关计算,易错题是(2),注意混合溶液的pH=6时溶液呈酸性,为易错点.

练习册系列答案
 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案
相关题目
1.T℃时,将3molX和4molY充入1L密闭容器中,发生反应X(g)+3Y(g)?Z(g)+W(g),溶液中Y的物质的量浓度随时间变化如图中实线I所示,图中Ⅱ、Ⅲ表示仅改变某一反应条件时,Y的物质的量浓度随时间的变化,下列说法正确的是( )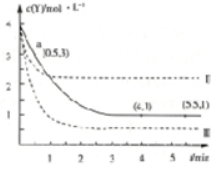

| A. | 反应开始至a点时,v(X)=1mol•L-1•min-1 | |
| B. | 4min时,正反应速率:Ⅱ>Ⅰ | |
| C. | 曲线Ⅲ对应点的条件改变是减小压强 | |
| D. | T℃时,该反应的化学平衡常数为1 |
2.NA代表阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 1.0L1.0mol•L-1的NaAlO2水溶液中含有的氧原子数数为2NA | |
| B. | 常温常压下,3.4gNH3中含N一H键数目为0.6NA | |
| C. | 过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.4NA | |
| D. | 标准状况下,33.6LCCl4中含有氯原子的数目为6NA. |
17.某溶液中可能含有下列离子:Na+、SO${\;}_{4}^{2-}$、Ba2+、NO${\;}_{3}^{-}$、OH-、NH${\;}_{4}^{+}$中的某几种离子,为确定该溶液的组成,某同学做了如下实验( )
(1)取少量上述溶液,向其中加入硫酸钠溶液,产生白色沉淀,加入稀硝酸沉淀不溶解;
(2)另取少量该溶液,向其中加入足量的NaOH溶液并加热,产生有刺激性气味的气体.则下列有关说法中不正确的是( )
(1)取少量上述溶液,向其中加入硫酸钠溶液,产生白色沉淀,加入稀硝酸沉淀不溶解;
(2)另取少量该溶液,向其中加入足量的NaOH溶液并加热,产生有刺激性气味的气体.则下列有关说法中不正确的是( )
| A. | 该溶液中一定含有NH${\;}_{4}^{+}$ | |
| B. | 该溶液中一定含有硝酸根离子 | |
| C. | 该溶液中一定含有SO${\;}_{4}^{2-}$ | |
| D. | 根据上述实验不能确定Na+是否存在 |
7.下列叙述中,不正确的是( )
| A. | 氧化还原反应的本质是电子发生转移 | |
| B. | 含化合价升高元素的反应物被氧化 | |
| C. | 得到电子的物质被氧化 | |
| D. | 2O3═3O2,不属于氧化还原反应 |
14.如图所示的钢铁的析氢腐蚀与吸氧腐蚀中,下列说法正确的是( )
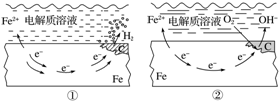

| A. | 碳表面发生氧化反应 | |
| B. | 钢铁被腐蚀的最终产物为FeO | |
| C. | 生活中钢铁制品的腐蚀以图①所示为主 | |
| D. | 图②中,正极反应式为O2+4e-+2H2O═4OH- |
11.设NA为阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 8gCH4所含原子数目为2NA | |
| B. | 0.5mol H2O含有的氢原子数目为1.5NA | |
| C. | 常温常压下,48g O3含有的氧原子为3NA | |
| D. | 1L 1mol•L-1 Na2SO4溶液中含有的氧原子为4NA |
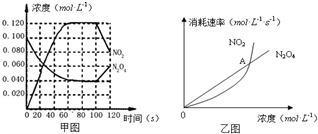 100℃时,在1L恒温恒容的密闭容器中,通入0.1mol N2O4,发生反应:N2O4(g)?2NO2(g)△H=+57.0kJ•mol-1,NO2和N2O4的浓度如图甲所示.NO2和N2O4的消耗速率与其浓度的关系如乙图所示,
100℃时,在1L恒温恒容的密闭容器中,通入0.1mol N2O4,发生反应:N2O4(g)?2NO2(g)△H=+57.0kJ•mol-1,NO2和N2O4的浓度如图甲所示.NO2和N2O4的消耗速率与其浓度的关系如乙图所示, A、B、C、D是元素周期表中前36号元素,它们的核电荷数依次增大.第二周期元素A原子的核外成对电子数是未成对电子数的2倍且有3个能级,B原子的最外层p轨道的电子为半充满结构,C是地壳中含量最多的元素.D是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满.请回答下列问题:
A、B、C、D是元素周期表中前36号元素,它们的核电荷数依次增大.第二周期元素A原子的核外成对电子数是未成对电子数的2倍且有3个能级,B原子的最外层p轨道的电子为半充满结构,C是地壳中含量最多的元素.D是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满.请回答下列问题: