题目内容
2.NA代表阿伏加德罗常数的值,下列叙述正确的是( )| A. | 1.0L1.0mol•L-1的NaAlO2水溶液中含有的氧原子数数为2NA | |
| B. | 常温常压下,3.4gNH3中含N一H键数目为0.6NA | |
| C. | 过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.4NA | |
| D. | 标准状况下,33.6LCCl4中含有氯原子的数目为6NA. |
分析 A、NaAlO2水溶液中除了偏铝酸钠本身含有氧原子,水中也含氧原子;
B、求出氨气的物质的量,然后根据1mol氨气中含3molN-H键来分析;
C、过氧化钠与水反应时,氧元素的价态由-1价变为0价;
D、标况下四氯化碳为液态.
解答 解:A、NaAlO2水溶液中除了偏铝酸钠本身含有氧原子,水中也含氧原子,故溶液中含有的氧原子的个数大于2NA个,故A错误;
B、3.4g氨气的物质的量为0.2mol,而1mol氨气中含3molN-H键,故0.2mol氨气中含0.6molN-H键即0.6NA个,故B正确;
C、过氧化钠与水反应时,氧元素的价态由-1价变为0价,故当生成0.1mol氧气时转移0.2mol电子即0.2NA个,故C错误;
D、标况下四氯化碳为液态,故不能根据气体摩尔体积来计算其物质的量和氯原子数目,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
12.按装置如图进行实验,若图的X轴表示流入阴极的电子的量,则Y轴不可能表示的( )
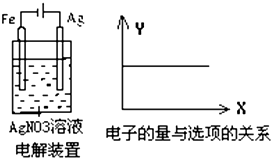

| A. | Ag+物质的量浓度 | B. | NO3-物质的量浓度 | ||
| C. | 溶液的pH | D. | 银棒的质量 |
10.下列变化过程中一定不存在化学能与热能相互转化的是( )
| A. | 蜡烛燃烧 | B. | 花香四溢 | C. | 点石成金 |
17.要求设计实验证明某种盐的水解是吸热的,有四位学生分别作出如下回答,其中不正确的是( )
| A. | 甲学生:在醋酸钠溶液中滴入酚酞试液,加热(不考虑水蒸发)后若红色加深,说明醋酸钠水解是吸热的 | |
| B. | 乙学生:将硝酸铵晶体溶于水,若水温下降,说明硝酸铵水解是吸热的 | |
| C. | 丙学生:取一定浓度的FeCl3溶液置于冰水中一段时间,发现溶液棕黄色变浅,说明FeCl3的水解是吸热的 | |
| D. | 丁学生:实验测定同浓度的热的纯碱液比冷的纯碱液pH高,说明碳酸钠水解是吸热的 |
7.下列物质的转化在给定条件下均能通过一步反应实现的是( )
| A. | NaAlO2(aq)→Al2O3→Al(OH)3 | B. | N2→NO2→HNO3 | ||
| C. | Na→Na2O2→Na2CO3 | D. | S→SO3→H2SO4 |
5.一定条件的密闭容器中:4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H=-905.9kJ•mol-1,下列叙述不正确 的是( )
| A. | NH3与O2起始时物质的量之比等于4:5,则平衡后两物质的转化率一定相等 | |
| B. | 平衡时4v正(O2)=5v逆(NO) | |
| C. | 平衡后降压,混合气体平均摩尔质量减小 | |
| D. | 达到平衡时放出热量为905.9 kJ,则起始时投入4mol NH3和5mol O2 |
3.下列说法中,正确的是( )
| A. | 向某溶液中加入氨水,产生白色沉淀,证明原溶液中存在Al3+ | |
| B. | 向某溶液中加入NaOH并加热,产生可使湿润红色石蕊试纸变蓝的气体,则原溶液中有NH4+ | |
| C. | 向某溶液中加入Ba(NO3)2溶液,产生白色沉淀,加入稀硝酸沉淀不溶解,则原溶液中有SO42- | |
| D. | 向某溶液中加入AgNO3溶液,产生白色沉淀,则原溶液中有Cl- |
 水的电离平衡曲线如图所示:
水的电离平衡曲线如图所示: