题目内容
1.T℃时,将3molX和4molY充入1L密闭容器中,发生反应X(g)+3Y(g)?Z(g)+W(g),溶液中Y的物质的量浓度随时间变化如图中实线I所示,图中Ⅱ、Ⅲ表示仅改变某一反应条件时,Y的物质的量浓度随时间的变化,下列说法正确的是( )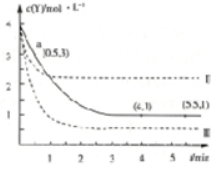
| A. | 反应开始至a点时,v(X)=1mol•L-1•min-1 | |
| B. | 4min时,正反应速率:Ⅱ>Ⅰ | |
| C. | 曲线Ⅲ对应点的条件改变是减小压强 | |
| D. | T℃时,该反应的化学平衡常数为1 |
分析 A.由图可知,a点Y的浓度为3mol/L,故Y的浓度变化量为4mol/L-3mol/L=1mol/L,根据v=$\frac{△c}{△t}$计算v(Y),再利用速率之比等于化学计量数之比计算v(X);
B.与曲线I相比,曲线Ⅱ到达平衡时间缩短,且Y的浓度增大,正反应为气体体积减小的反应,不能是增大压强,曲线Ⅱ应是升高温度或增大X的浓度;
C.与曲线I相比,曲线Ⅲ到达平衡时间缩短,且Y浓度很小,平衡正向移动,正反应为气体体积减小的反应,应是增大压强;
D.T℃时,将3molX和4molY充入1L密闭容器中,由图可知,T℃时平衡时Y浓度为1mol/L,则:
X(g)+3Y(g)?Z(g)+W(g)
起始浓度(mol/L):3 4 0 0
变化浓度(mol/L):1 3 1 1
平衡浓度(mol/L):2 1 1 1
代入K=$\frac{c(Z)×c(W)}{c(X)×{c}^{3}(Y)}$计算平衡常数.
解答 解:A.由图可知,a点Y的浓度为3mol/L,故Y的浓度变化量为4mol/L-3mol/L=1mol/L,则v(Y)=$\frac{1mol/L}{0.5min}$=2mol/(L.min),速率之比等于化学计量数之比,故v(X)=$\frac{1}{3}$v(Y)=0.67mol/(L.min),故A错误;
B.与曲线I相比,曲线Ⅱ到达平衡时间缩短,且Y的浓度增大,正反应为气体体积减小的反应,不能是增大压强,曲线Ⅱ应是升高温度或增大X的浓度,温度越高、浓度越大反应速率快,故4min时,正反应速率:Ⅱ>Ⅰ,故B正确;
C.若改变是减小压强,反应速率减慢,到达平衡时间更长,而与曲线I相比,曲线Ⅲ到达平衡时间缩短,且Y浓度很小,平衡正向移动,正反应为气体体积减小的反应,应是增大压强,故C错误;
D.T℃时,将3molX和4molY充入1L密闭容器中,由图可知,T℃时平衡时Y浓度为1mol/L,则:
X(g)+3Y(g)?Z(g)+W(g)
起始浓度(mol/L):3 4 0 0
变化浓度(mol/L):1 3 1 1
平衡浓度(mol/L):2 1 1 1
故平衡常数K=$\frac{c(Z)×c(W)}{c(X)×{c}^{3}(Y)}$=$\frac{1×1}{1×{1}^{3}}$=0.5,故D错误,
故选:A.
点评 本题考查化学平衡影响因素、反应速率计算与影响因素、平衡常数计算、化学平衡图象等,注意分析图象中到达平衡时间及Y浓度变化,结合反应的特点判断改变条件.

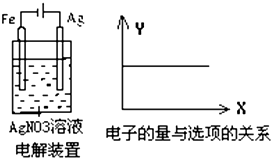
| A. | Ag+物质的量浓度 | B. | NO3-物质的量浓度 | ||
| C. | 溶液的pH | D. | 银棒的质量 |
| A. | 水晶、陶瓷、玻璃的主要成分都是硅酸盐 | |
| B. | 合金的熔点通常比組分金属低.硬度比组合分金属高 | |
| C. | 自行车钢架生锈主要是电化学腐蚀所致 | |
| D. | 聚氯乙烯不能做食品包装袋 |
| A. | 蜡烛燃烧 | B. | 花香四溢 | C. | 点石成金 |
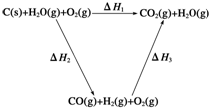 已知:①将煤转化为水煤气的主要化学反应为C(s)+H2O(g)$\frac{\underline{\;高温\;}}{\;}$CO(g)+H2(g);
已知:①将煤转化为水煤气的主要化学反应为C(s)+H2O(g)$\frac{\underline{\;高温\;}}{\;}$CO(g)+H2(g);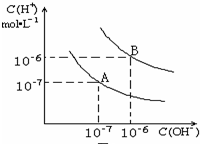 水的电离平衡曲线如图所示:
水的电离平衡曲线如图所示: