题目内容
7.下列叙述中,不正确的是( )| A. | 氧化还原反应的本质是电子发生转移 | |
| B. | 含化合价升高元素的反应物被氧化 | |
| C. | 得到电子的物质被氧化 | |
| D. | 2O3═3O2,不属于氧化还原反应 |
分析 A.氧化还原反应的特征为化合价变化,化合价变化由电子转移决定;
B.元素的化合价升高,失去电子被氧化;
C.氧化剂得到电子被还原;
D.2O3═3O2中不存在元素的化合价变化.
解答 解:A.氧化还原反应的特征为化合价变化,则氧化还原反应的本质是电子发生转移,故A正确;
B.元素的化合价升高,失去电子被氧化,则含化合价升高元素的反应物被氧化,故B正确;
C.氧化剂得到电子发生还原反应,则得到电子的物质被还原,故C错误;
D.2O3═3O2中不存在元素的化合价变化,则不属于氧化还原反应,故D正确;
故选C.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念及分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
7.下列物质的转化在给定条件下均能通过一步反应实现的是( )
| A. | NaAlO2(aq)→Al2O3→Al(OH)3 | B. | N2→NO2→HNO3 | ||
| C. | Na→Na2O2→Na2CO3 | D. | S→SO3→H2SO4 |
12.下列与化学反应能量变化相关的叙述中不正确的是( )
| A. | 化学反应除了生成新的物质外,还伴随着能量的变化 | |
| B. | 应用盖斯定律,可计算某些难以直接测量的反应焓变 | |
| C. | 同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件下的△H相同 | |
| D. | 在101kPa时,2g H2完全燃烧生成液态水,放出285.8 kJ 热量,氢气燃烧的热化学方程式表示为:2H2(g)+02(g)=2H20(l);△H=+285.8 kJ•mol-1 |
19.氢叠氮酸(HN3)与醋酸酸性相近,其盐稳定,但撞击发生爆炸生成氮气,有关氢叠氮酸的叙述有:
①NaN3的水溶液呈碱性;
②HN3的固体属于分子晶体;
③NaN3的固体属于离子晶体;
④NaN3可用于小汽车防撞保护气囊.
其中正确的是( )
①NaN3的水溶液呈碱性;
②HN3的固体属于分子晶体;
③NaN3的固体属于离子晶体;
④NaN3可用于小汽车防撞保护气囊.
其中正确的是( )
| A. | 全部 | B. | ②③④ | C. | ①③④ | D. | ①②③ |
17.设NA为阿佛加德罗常数,以下说法正确的是( )
| A. | 同温同压下,体积相同的氢气和氩气所含的分子数相等 | |
| B. | 标准状况下22.4 L乙醇中分子数为NA | |
| C. | 在1 L 2 mol/L的盐酸中,存在2NA个氯化氢分子 | |
| D. | 1.8g的NH4+中含有的电子数为1.1NA |
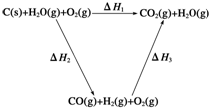 已知:①将煤转化为水煤气的主要化学反应为C(s)+H2O(g)$\frac{\underline{\;高温\;}}{\;}$CO(g)+H2(g);
已知:①将煤转化为水煤气的主要化学反应为C(s)+H2O(g)$\frac{\underline{\;高温\;}}{\;}$CO(g)+H2(g);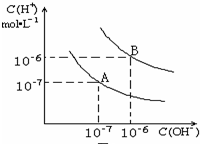 水的电离平衡曲线如图所示:
水的电离平衡曲线如图所示: