题目内容
10.回收铅蓄电池的电极填充物(铅膏,主要含PbO、PbO2、PbSO4),可制备热稳定剂三盐基硫酸铅(组成可表示为3PbO•PbSO4•H2O),其实验流程如下:
(1)物质X可以循环利用,该物质是HNO3溶液.最后一次过滤之后需要洗涤,检验三盐基硫酸铅是否洗净的方法是取少量溶液,加入足量稀盐酸,再加氯化钡溶液,观察是否产生白色沉淀.
(2)从滤液A可提取出一种含结晶水的钠盐副产品.若检验该晶体中结晶水的含量,所需的硅酸盐材质仪器有坩埚、酒精灯、泥三角、玻璃棒、石棉网、干燥器等.
(3)流程中不直接利用H2SO4溶液与PbO、PbCO3反应制取PbSO4,原因可能是PbSO4不溶于水,覆盖在固体表面阻碍反应的进一步发生.
(4)生成三盐基硫酸铅的离子反应方程式为4PbSO4+6OH-=3PbO•PbSO4•H2O+3SO42-+2H2O.
(5)向铅膏浆液中加入Na2SO4溶液的目的是将其中的PbO2还原为PbO.若实验中所取铅膏的质量为47.8g,其中PbO2的质量分数为15.0%,则要将PbO2全部还原,至少需加30mL 1.0mol•L-lNa2SO3溶液.
分析 (1)利用废旧铅蓄电池阴、阳极填充物(铅膏)制备塑料加工热稳定剂三盐基硫酸铅实验流程.向铅膏浆液中加入Na2SO3溶液的目的是将PbO2还原PbO,Na2SO3+PbO2=PbO+Na2SO4,加Na2CO3溶液是将PbSO4转化成PbCO3,所以滤液Ⅰ主要是Na2SO4溶液.PbO和PbCO3在硝酸的作用下转化成Pb(NO3).Pb(NO3)中加稀H2SO4转化成PbSO4和硝酸,因此X为HNO3,可循环利用;如果变质说明变成硫酸钡,可以通过检验是否生成硫酸根离子;
(2)测量晶体中结晶水的含量,实验步骤为:①研磨 ②称量空坩埚和装有试样的坩埚的质量 ③加热 ④冷却 ⑤称量 ⑥重复③至⑤的操作,直到连续两次称量的质量差不超过0.1g为止 ⑦根据实验数据计算晶体中结晶水的含量,所以所需的硅酸盐材质仪器有玻璃棒、石棉网、干燥器、坩埚、酒精灯、泥三角;
(3)生成的硫酸铅难溶于水,覆盖在固体PbO、PbCO3的表面,阻碍反应的进一步发生;
(4)从流程看,硫酸铅和氢氧化钠反应生成三盐基硫酸铅和硫酸钠,据此写出方程式;
(5)根据铅膏的质量及氧化铅的质量分数可计算出氧化铅的物质的量,根据亚硫酸钠和氧化铅反应关系可计算需要亚硫酸钠的体积.
解答 解:(1)分析流程可知,PbO和PbCO3在硝酸的作用下转化成Pb(NO3).Pb(NO3)中加稀H2SO4转化成PbSO4和硝酸,因此X为HNO3,可循环利用,检验硫酸根离子的方法为:取少量晶体溶于蒸馏水,然后用盐酸酸化,再滴BaCl2溶液,若出现白色沉淀,即证明该晶体中含有SO42-,
故答案为:HNO3溶液;取少量溶液,加入足量稀盐酸,再加氯化钡溶液,观察是否产生白色沉淀;
(2)测量晶体中结晶水的含量,实验步骤为:①研磨 ②称量空坩埚和装有试样的坩埚的质量 ③加热 ④冷却 ⑤称量 ⑥重复③至⑤的操作,直到连续两次称量的质量差不超过0.1g为止 ⑦根据实验数据计算晶体中结晶水的含量,所以所需的硅酸盐材质仪器有玻璃棒、石棉网、干燥器、坩埚、酒精灯、泥三角,
故答案为:坩埚;酒精灯;泥三角;
(3)生成的硫酸铅难溶于水,覆盖在固体PbO、PbCO3的表面,阻碍反应的进一步发生,故答案为:PbSO4不溶于水,覆盖在固体表面阻碍反应的进一步发生;
(4)从流程看,硫酸铅和氢氧化钠反应生成三盐基硫酸铅和硫酸钠,反应方程式为:4PbSO4+6NaOH=3PbO•PbSO4•H2O+3Na2SO4+2H2O,离子方程式为:
4PbSO4+6OH-=3PbO•PbSO4•H2O+3SO42-+2H2O,故答案为:4PbSO4+6OH-=3PbO•PbSO4•H2O+3SO42-+2H2O;
(5)氧化铅的物质的量为:$\frac{47.8g×15%}{239g/mol}$=0.03mol,
PbO2 ~Na2SO3
1mol 1mol
0.03mol n
n=0.03mol,V=$\frac{0.03mol}{1.0mol/L}$=0.03L=30mL,
故答案为:30.
点评 本题考查了实验方案的设计,侧重于物质分离和提纯的方法和基本操作综合应用,难度中等,要分析流程,从流程中所给信息结合题目设问解题.

| A. | 用HA溶液做导电实验,灯泡很暗 | |
| B. | HA和CaCO3发生反应放出CO2 | |
| C. | pH=2的HA溶液稀释至100倍,pH小于4 | |
| D. | pH=3的HA溶液中水电离出的c(H+)为10-11mol•L-1 |
| A. | Na2O•SiO2是一种简单的硅酸盐,可溶于水 | |
| B. | 严重影响我国北方的霾尘,其颗粒物是种胶体 | |
| C. | 盐酸、NaCl溶液是实验室常见的电解质 | |
| D. | 酸性氧化物均能与水反应生成对应的酸,如CO2、SO3等 |
| A. | X原子在反应中得到的电子数比Y原子在反应中得到的电子数少 | |
| B. | 气态氢化物 Y比X稳定 | |
| C. | X的最高正价比Y的最高正价高 | |
| D. | X单质能与Y的氢化物反应生成Y单质 |
| A. | 准确量取20.00mL高锰酸钾溶液,可选用25 mL碱式滴定管 | |
| B. | 将水加热,Kw增大,pH不变 | |
| C. | 用惰性电极电解1 L浓度均为2 mol/L的AgNO3与Cu(NO3)2的混合溶液,当有0.2 mol电子转移时,阴极析出6.4g金属 | |
| D. | CuSO4 的水溶液经加热浓缩、蒸干灼烧后能得到CuSO4固体 |

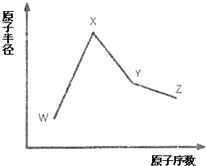 W、X、Y和Z是常见的短周期元素,其原子半径随原子序数变化如图所示.己知W的一种核素的质量数为18,中子数为10;X和Ne的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的原子半径在同周期主族元素中最小.
W、X、Y和Z是常见的短周期元素,其原子半径随原子序数变化如图所示.己知W的一种核素的质量数为18,中子数为10;X和Ne的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的原子半径在同周期主族元素中最小. .
.