题目内容
7.以溴苯(p=1.5/cm3)为原料经以下反应原理可获得重要的有机合成中间体2-苯基-2-丁醇(p=1.0g/cm3)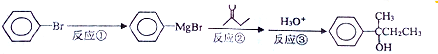
【实验装置】:

【实验步骤】:
步骤:1:将镁条置于装置Ⅰ的a容器中,加入一定量乙醚(p=0.71g/cm3),在冷却条件下缓慢滴入40mL溴苯,微热并加入一小块碘引发反应①
步骤2:滴加足量的丁酮和乙醛混合物,发生反应②:滴加入20%的NH4Cl水溶液,发生反应③
步骤3:分出油层,用水洗涤至中性,加适量无水CaCl2
步骤4:用装置Ⅱ先蒸出乙醛,再蒸馏得到36.0mL产品
(1)仪器a的名称是三颈烧瓶.
(2)步骤Ⅰ中加入碘的作用是催化剂;步骤3中加入适量无水CaCl2的作用是干燥作用
(3)装置中滴加液体用恒压漏斗替代普通分液漏斗的优点是便于液体滴加,反应②需将三颈烧瓶置于冰水中,且逐滴加入丁酮和乙醛,其目的是该反应放热,防止反应过于剧烈.
(4)步骤三种分离出油层的具体实验操作是将混合液置于分液漏斗中,先放出下层液体于烧杯中,再将上层液体从上口倒入另一烧杯中.
(5)步骤Ⅱ采用的减压蒸馏,而不是常压蒸馏,采用这种蒸馏方式的原因是降低2-苯基-2-丁醇的沸点,防止温度过高发生分解.
(6)本次所得产品的产率是57.3%(保留小数点后一位小数)
分析 根据题中各物质的转化关系可知,本实验是将溴苯先与镁反应(反应①)生成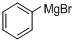 ,
, 与丁酮反应(反应②)生成
与丁酮反应(反应②)生成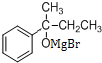 ,
, 再与酸反应(反应③)生成
再与酸反应(反应③)生成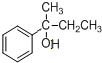 .
.
(1)根据图示仪器a为三颈烧瓶;
(2)反应①是用溴苯与镁条反应,用碘作催化剂;无水CaCl2具有吸水作用;
(3)装置Ⅰ中滴加液体用恒压漏斗,便于液体流下,反应②是放热反应,为防止反应过于剧烈,需将三颈烧瓶置于冰水中,且逐滴加入丁酮和乙醚;
(4)根据分液的基本步骤答题;
(5)减压蒸馏主要是防止温度过高物质发生分解,根据压蒸馏的操作要求答题;
(6)根据溴苯的质量计算2-苯基-2-丁醇的理论产量,产量=(实际产量÷理论产量)×100%.
解答 解:(1)仪器a有三个颈的烧瓶,名称叫三颈烧瓶,
故答案为:三颈烧瓶;
(2)反应①是用溴苯与镁条反应,用碘作催化剂,无水CaCl2具有吸水作用步骤3中加入适量无水CaCl2起干燥作用,
故答案为:催化剂;干燥作用;
(3)装置Ⅰ中滴加液体用恒压漏斗,便于液体滴加,反应②是放热反应,为防止反应过于剧烈,需将三颈烧瓶置于冰水中,且逐滴加入丁酮和乙醚,
故答案为:便于液体滴加;该反应放热,防止反应过于剧烈;
(4)步骤三中分离出油层,用分液操作即可,具体实验操作为:将混合液置于分液漏斗中,先放出下层液体于烧杯中,再将上层液体从上口倒入另一烧杯中,
故答案为:将混合液置于分液漏斗中,先放出下层液体于烧杯中,再将上层液体从上口倒入另一烧杯中;
(5)减压蒸馏时需将吸滤瓶与抽气泵相连,减压蒸馏主要是降低2-苯基-2-丁醇的沸点,防止温度过高发生分解,
故答案为:降低2-苯基-2-丁醇的沸点,防止温度过高发生分解;
(6)40mL溴苯(p=1.5g/cm3)质量为:m=ρv=60g,36.0mL2-苯基-2-丁醇(p=1.0g/cm3)质量为:m=ρv=36g
溴苯完全反应生成2-苯基-2-丁醇的理论产量为60g×$\frac{157}{150}$=62.8g,故2-苯基-2-丁醇的产率为$\frac{36g}{62.8g}$×100%≈57.3%,
故答案为:57.3%.
点评 本题考查有机物制备实验,涉及对装置及操作的分析评价、物质的分离提纯、产率计算等,注意操作规范性及仪器作用,理解实验原理是解题的关键,题目难度中等.

| A. | S既作氧化剂又作还原剂 | B. | 消耗12gC时,反应转移5mol电子 | ||
| C. | 还原产物只有K2S | D. | KNO3只发生氧化反应 |
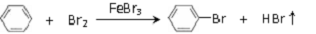
反应剧烈进行,烧瓶中有大量红棕色蒸气,锥形瓶中导管口有白雾出现,蒸馏水逐渐变成黄色.反应停止后按
如图2流程分离产品:
已知:溴苯难溶于水,与有机溶剂互溶;溴、苯、溴苯的沸点依次为59℃、80℃、156℃.
(1)操作Ⅰ为过滤,操作Ⅱ为蒸馏.
(2)“水洗”、“NaOH溶液洗”需要用到的玻璃仪器是分液漏斗、烧杯.
(3)向“水洗”后所得水相中滴加KSCN溶液,溶液变红色.推测水洗的主要目的是除去FeBr3.
(4)锥形瓶中蒸馏水变黄的原因是溶解了从烧瓶中挥发出的溴.
(5)已知苯与溴发生的是取代反应,推测反应后锥形瓶中液体含有的两种大量离子,并设计实验方案验证你的推测.
(限选试剂:镁条、四氯化碳、氯水、溴水、蒸馏水)
| 序号 | 实验步骤 | 预期现象 | 结论 |
| 1 | |||
| 2 | 锥形瓶中液体含大量Br- | ||
| 3 | 锥形瓶中液体含大量H+ |

有关数据列表如下:
| 物质 状态 | 密度/g•cm3 | 沸点/℃熔点/℃ |
| 乙醇 无色液体 | 0.79 | 78.5/-130 |
| 1,2-二溴乙烷 无色液体 | 2.2 | 132/9 |
| 乙醚 无色液体 | 0.71 | 34.6/-116 |
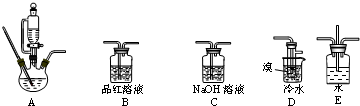
请完成下列填空:
(1)实验装置的正确的连接顺序是(用仪器装置的字母填空,装置可重复选用)A→C→B→D→C;
(2)检查装置A气密性的方法是关闭恒压漏斗活塞,将导管浸入水中,对三颈烧瓶进行加热,导管口有气泡冒出,停止加热后导管内形成一段稳定的水柱,说明装置A气密性良好,反之气密性不好;
(3)A中药品为1:3的无水乙醇和浓硫酸混合液,写出制备乙烯的化学方程式:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2═CH2↑+H2O;
(4)反应过程中应用冷水冷却装置D但又不能过度冷却,其原因是溴易挥发,冷却可以减少溴的挥发,而1,2-二溴乙烷的熔点为9℃,过度冷却可以使1,2-二溴乙烷凝结成固体,容易发生堵塞;
(5)学生发现反应结束时,无水乙醇消耗量大大超过理论值,其原因是乙醇易挥发、反应中存在副反应、反应剧烈导致乙烯与溴反应不完全等;
(6)老师建议,在A、B间加入装置E会更好,理由平衡装置内气体,防止倒吸.
| 选项 | 实验操作 | 现象 | 解释或结论 |
| A | 鸡蛋白溶液中分别滴入饱和硫酸铵和醋酸铅溶液 | 均有固体析出 | 均发生变性 |
| B | 溴水中分别加入苯酚和环己烯 | 溴水均褪色 | 均发生加成反应 |
| C | 某无色气体通入溴水中 | 溴水褪色 | 该气体一定是C2H4 |
| D | 适量水玻璃加入稀盐酸中, 振荡得透明溶液,用激光笔照射 | 有丁达尔效应 | 有硅酸胶体生成 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 蔗糖、麦芽糖互为同分异构体 | |
| B. | 常用蛋白质的颜色反应来鉴别部分蛋白质 | |
| C. | 用Na2CO3溶液不能区分CH3COOH和CH3COOCH2CH3 | |
| D. | 油脂在酸性或碱性条件下均能发生水解反应,且产物不同 |

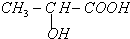 ,现以A为主要原料合成乙酸乙酯,其合成路线如图所示.
,现以A为主要原料合成乙酸乙酯,其合成路线如图所示.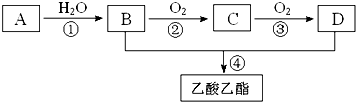
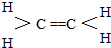 .
.