题目内容
15.下列各项叙述中一定能说明元素X的非金属性比元素Y的非金属性强的是( )| A. | X原子在反应中得到的电子数比Y原子在反应中得到的电子数少 | |
| B. | 气态氢化物 Y比X稳定 | |
| C. | X的最高正价比Y的最高正价高 | |
| D. | X单质能与Y的氢化物反应生成Y单质 |
分析 非金属的非金属性越强,其单质的氧化性越强,其最高价氧化物的水化物酸性越强、其氢化物的稳定性越强,据此分析解答.
解答 解:A.X原子在反应中得到的电子数比Y原子在反应中得到的电子数少,不能说明X的非金属性比Y强,如Cl元素的非金属性大于Y,故A错误;
B.元素的非金属性越强,其氢化物的稳定性越强,气态氢化物Y比X稳定,说明Y非金属性比X强,故B错误;
C.X的最高正价比Y的最高正价高,不能说明X的非金属性大于Y,如Se的最高正价大于N元素,但非金属性N>Se,故C错误;
D.X单质能与Y的氢化物反应生成Y单质,说明X单质的氧化性大于Y,则非金属性X大于Y,故D正确;
故选D.
点评 本题考查非金属性强弱判断,为高频考点,明确非金属性强弱与单质氧化性、最高价氧化物水化物酸性、氢化物的稳定性之间关系是解本题关键,与得电子多少无关,为易错点.

练习册系列答案
相关题目
20.甘氨酸和丙氨酸以1:1的配比两两缩合后,得到的产物可能是( )
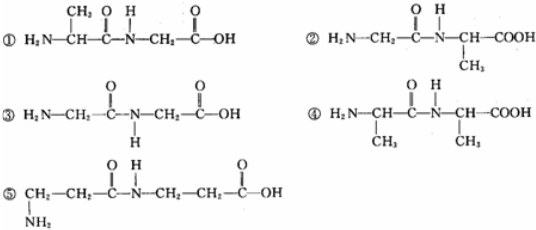

| A. | ①② | B. | ①②③ | C. | ①②③④ | D. | ①②③④⑤ |
12.实验室利用下列仪器装置,由乙烯与溴的四氯化碳溶液反应制备1.2-二溴乙烷(加热及夹持设备已略).
有关数据列表如下:
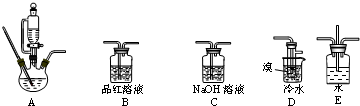
请完成下列填空:
(1)实验装置的正确的连接顺序是(用仪器装置的字母填空,装置可重复选用)A→C→B→D→C;
(2)检查装置A气密性的方法是关闭恒压漏斗活塞,将导管浸入水中,对三颈烧瓶进行加热,导管口有气泡冒出,停止加热后导管内形成一段稳定的水柱,说明装置A气密性良好,反之气密性不好;
(3)A中药品为1:3的无水乙醇和浓硫酸混合液,写出制备乙烯的化学方程式:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2═CH2↑+H2O;
(4)反应过程中应用冷水冷却装置D但又不能过度冷却,其原因是溴易挥发,冷却可以减少溴的挥发,而1,2-二溴乙烷的熔点为9℃,过度冷却可以使1,2-二溴乙烷凝结成固体,容易发生堵塞;
(5)学生发现反应结束时,无水乙醇消耗量大大超过理论值,其原因是乙醇易挥发、反应中存在副反应、反应剧烈导致乙烯与溴反应不完全等;
(6)老师建议,在A、B间加入装置E会更好,理由平衡装置内气体,防止倒吸.
有关数据列表如下:
| 物质 状态 | 密度/g•cm3 | 沸点/℃熔点/℃ |
| 乙醇 无色液体 | 0.79 | 78.5/-130 |
| 1,2-二溴乙烷 无色液体 | 2.2 | 132/9 |
| 乙醚 无色液体 | 0.71 | 34.6/-116 |

请完成下列填空:
(1)实验装置的正确的连接顺序是(用仪器装置的字母填空,装置可重复选用)A→C→B→D→C;
(2)检查装置A气密性的方法是关闭恒压漏斗活塞,将导管浸入水中,对三颈烧瓶进行加热,导管口有气泡冒出,停止加热后导管内形成一段稳定的水柱,说明装置A气密性良好,反之气密性不好;
(3)A中药品为1:3的无水乙醇和浓硫酸混合液,写出制备乙烯的化学方程式:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2═CH2↑+H2O;
(4)反应过程中应用冷水冷却装置D但又不能过度冷却,其原因是溴易挥发,冷却可以减少溴的挥发,而1,2-二溴乙烷的熔点为9℃,过度冷却可以使1,2-二溴乙烷凝结成固体,容易发生堵塞;
(5)学生发现反应结束时,无水乙醇消耗量大大超过理论值,其原因是乙醇易挥发、反应中存在副反应、反应剧烈导致乙烯与溴反应不完全等;
(6)老师建议,在A、B间加入装置E会更好,理由平衡装置内气体,防止倒吸.
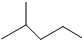 ,A的名称是2-甲基戊烷. 若A是炔烃B氢化而成,则B的结构有2种
,A的名称是2-甲基戊烷. 若A是炔烃B氢化而成,则B的结构有2种 和
和 F.
F. 和
和 G.
G. 和
和


 实验室用如图装置制取少量溴苯,试填写下列空白.
实验室用如图装置制取少量溴苯,试填写下列空白.