题目内容
8.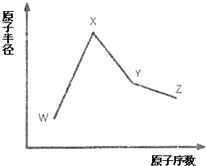 W、X、Y和Z是常见的短周期元素,其原子半径随原子序数变化如图所示.己知W的一种核素的质量数为18,中子数为10;X和Ne的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的原子半径在同周期主族元素中最小.
W、X、Y和Z是常见的短周期元素,其原子半径随原子序数变化如图所示.己知W的一种核素的质量数为18,中子数为10;X和Ne的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的原子半径在同周期主族元素中最小.(1)W的核素符号是188O.
(2)用电子式表示X和Z形成的化合物
 .
.(3)Y与W形成的化合物与X的最高价氧化物的水化物反应的离子方程式是SiO2+2OH-=SiO32-+H2O.
(4)X与W形成的原子个数比为1:1的化合物中含有的化学键类型有AC(填序号).
A.离子键 B.极性共价键 C.非极性共价键 D.氢键
(5)W与周期表中半径最小的原子按原子个数1:1组成的常见液态化合物的稀溶液易被催化分解,来加快产生常见的某气体;可使用的催化剂为MnO2(填化学式)和FeCl3.
分析 W、X、Y、Z是四种常见的短周期元素,W的一种核素的质量数为18,中子数为10,则其质子数为18-10=8,故W为O元素;X和Ne原子的核外电子数相差1,且原子半径大于氧,所以X为Na元素;Y的单质是一种常见的半导体材料,原子序数大于Na,故Y为Si;Z的原子半径在同周期主族元素中最小,则Z为第ⅤⅡA族元素,原子序数大于Si,所以Z为Cl元素,据此解答.
解答 解:W、X、Y、Z是四种常见的短周期元素,W的一种核素的质量数为18,中子数为10,则其质子数为18-10=8,故W为O元素;X和Ne原子的核外电子数相差1,且原子半径大于氧,所以X为Na元素;Y的单质是一种常见的半导体材料,原子序数大于Na,故Y为Si;Z的原子半径在同周期主族元素中最小,则Z为第ⅤⅡA族元素,原子序数大于Si,所以Z为Cl元素.
(1)W的一种核素的质量数为18,中子数为10,则其质子数为18-10=8,故W为O元素该核素符号为188O,故答案为:188O;
(2)X和Z形成的化合物为NaCl,用电子式表示其形成过程为: ,
,
故答案为: ;
;
(3)Y与W形成的化合物为SiO2,X的最高价氧化物的水化物为NaOH,二者反应的离子方程式是:SiO2+2OH-=SiO32-+H2O,故答案为:SiO2+2OH-=SiO32-+H2O;
(4)X与W形成的原子个数比为1:1的化合物为Na218O2,含有离子键、非极性键,故选:AC;
(5)W与周期表中半径最小的原子按原子个数1:1组成的常见液态化合物为H2O2,H2O2的稀溶液易被催化分解,来加快产生常见的某气体,可使用的催化剂为MnO2、FeCl3,故答案为:MnO2;FeCl3.
点评 本题考查位置结构性质关系应用,推断元素是解题关键,侧重对化学用语与元素周期律的考查,有利于学生对基础知识的巩固,难度中等.

 阅读快车系列答案
阅读快车系列答案| 选项 | 实验操作 | 现象 | 解释或结论 |
| A | 鸡蛋白溶液中分别滴入饱和硫酸铵和醋酸铅溶液 | 均有固体析出 | 均发生变性 |
| B | 溴水中分别加入苯酚和环己烯 | 溴水均褪色 | 均发生加成反应 |
| C | 某无色气体通入溴水中 | 溴水褪色 | 该气体一定是C2H4 |
| D | 适量水玻璃加入稀盐酸中, 振荡得透明溶液,用激光笔照射 | 有丁达尔效应 | 有硅酸胶体生成 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 甲烷 | B. | 乙烷 | C. | 乙烯 | D. | 苯 |
| A. | CH3CH2CH2OH+HBr$→_{H+}^{△}$CH3CH2CH2Br+H2O | |
| B. | 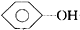 +NaHCO3→ +NaHCO3→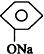 +H2CO3 +H2CO3 | |
| C. | 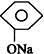 +CO2+H2O→ +CO2+H2O→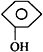 +NaHCO3 +NaHCO3 | |
| D. |  +3Br2→ +3Br2→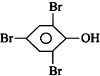 ↓+3HBr ↓+3HBr |
| A. | 蔗糖、麦芽糖互为同分异构体 | |
| B. | 常用蛋白质的颜色反应来鉴别部分蛋白质 | |
| C. | 用Na2CO3溶液不能区分CH3COOH和CH3COOCH2CH3 | |
| D. | 油脂在酸性或碱性条件下均能发生水解反应,且产物不同 |

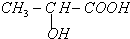 ,现以A为主要原料合成乙酸乙酯,其合成路线如图所示.
,现以A为主要原料合成乙酸乙酯,其合成路线如图所示.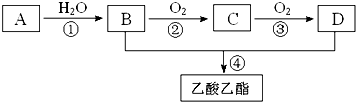
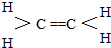 .
. 实验室用如图装置制取少量溴苯,试填写下列空白.
实验室用如图装置制取少量溴苯,试填写下列空白.